Fissaidee 1
3. Elementi, sostanze semplici e sostanze composte
All’inizio dell’800 il concetto di elemento (o più correttamente di sostanza semplice) e di composto (o sostanza composta) erano concetti “operativi”, che avevano significato nel “registro macroscopico” delle sostanze:
- sostanza semplice (o elemento): una sostanza che non poteva essere decomposta in sostanze più semplici mediante processi di trasformazione chimica;
- sostanza composta (o composto): una sostanza che poteva essere decomposta in sostanze più semplici mediante processi di trasformazione chimica.
Come si vedrà nel seguito, ora intendiamo per elemento una specie atomica caratterizzata da: un ugual numero di numero di protoni nel nucleo atomico (ovvero dal suo numero atomico Z); un nome; un simbolo; una posizione definita nella tavola periodica.
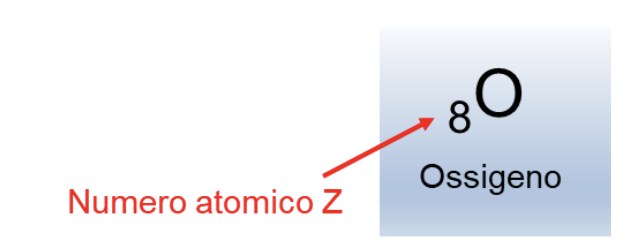
Sulla base della teoria atomica possiamo quindi definire:
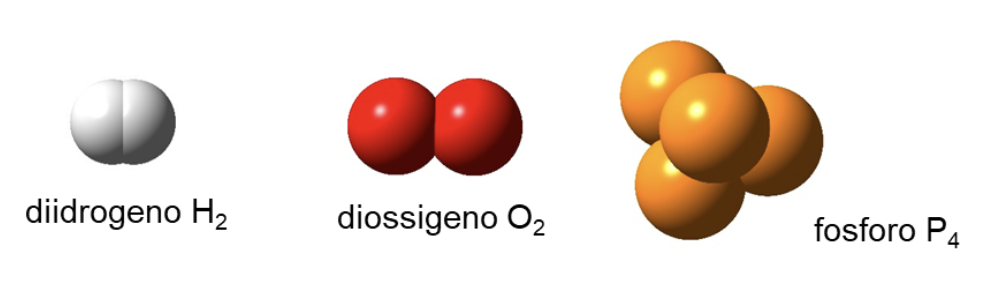
sostanza semplice: una sostanza costituita da atomi di un solo elemento
Alcuni elementi sono presenti in natura come sostanze semplici:
- come specie monoatomiche, ad esempio: l’Elio (He), il Neon (Ne) e gli altri gas nobili;
- come molecole biatomiche, ad esempio: H2, N2, O2, F2, Cl2, Br2, I2;
- come molecole poliatomiche, ad esempio P4, S8, Se8, C60 (noto come fullerene);
- alcuni sono invece presenti come solidi metallici (Fe, Cu) e altri come solidi reticolari covalenti (diamante, grafite, silicio).
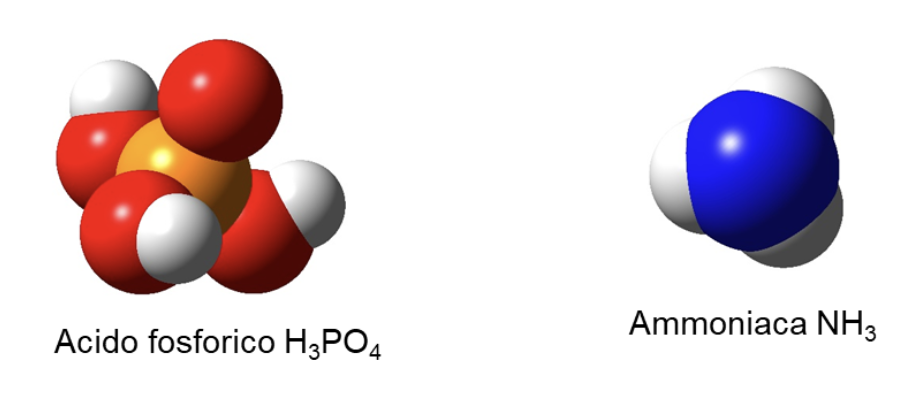
Sostanza composta: una sostanza costituita da atomi di elementi diversi.
Le sostanze composte costituiscono la stragrande maggioranza delle sostanze presenti sul nostro pianeta. Ad esempio, l’acido fosforico è formato dagli elementi fosforo, ossigeno e idrogeno; l’ammoniaca, dagli elementi azoto e idrogeno.
Sulla Terra la maggior parte degli elementi non si trova sotto forma di sostanze semplici ma si trova combinata chimicamente con altri elementi a formare sostanze composte. Ad esempio, il sodio si trova combinato con il cloro a formare il cloruro di sodio NaCl (sale da cucina), così come si ritrova in molti altri composti.