Fissaidee 2
6. La configurazione elettronica degli atomi
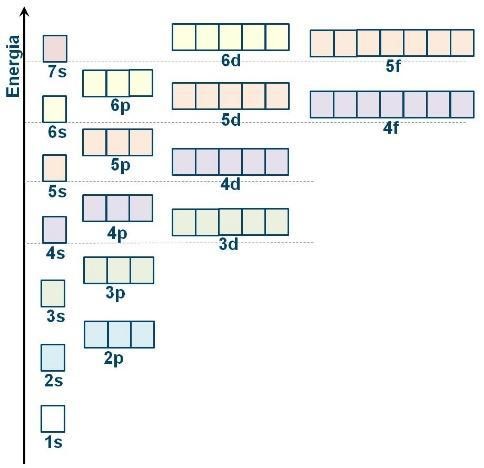
La configurazione elettronica degli atomiL’insieme delle funzioni d’onda, ovvero degli orbitali, che descrivono gli elettroni di un atomo è chiamata configurazione elettronica.
Lo stato di più bassa energia di un atomo (stato fondamentale) è quello nel quale gli elettroni sono descritti dagli orbitali di più bassa energia. Ne consegue la regola di Aufbau, secondo la quale la configurazione elettronica fondamentale si costruisce assegnando gli elettroni agli orbitali a partire da quelli di più bassa energia.
Nota: Anche se ad essere rigorosi la terminologia è errata, comunemente ci si riferisce agli elettroni di un atomo come elettroni che “occupano” gli orbitali dell’atomo stesso. In realtà, l’orbitale non è occupato da un elettrone, ma l’orbitale (cioè la funzione d’onda) è l’elettrone, nell’ambito del formalismo che utilizziamo per descrivere gli atomi.
In un atomo non possono coesistere elettroni caratterizzati dai quattro numeri quantici identici. Ne consegue che in uno stesso orbitale (caratterizzato da una terna di numeri quantici) possono essere presenti al massimo due elettroni, che devono avere numero quantico ms (il quarto numero quantico), ovvero spin, differente. Inoltre, secondo quella che è conosciuta come la regola di Hund, se sono presenti orbitali iso-energetici, nel descrivere la configurazione elettronica dell’atomo in esame, prima si colloca un elettrone su ciascun orbitale vuoto, e poi si completano gli orbitali semipieni. Nella configurazione elettronica più stabile di un atomo, gli elettroni che occupano singolarmente orbitali iso-energetici tendono ad assumere lo stesso spin.