Fissaidee 2
6. Proprietà chimiche dei composti binari covalenti
Gli ossidi covalenti, al pari degli ossidi ionici, possono reagire con l’acqua. In questo caso, vengono comunemente definiti anidridi, termine di origine greca che vuol dire letteralmente ‘privo di acqua’.
L’esito della reazione è tuttavia molto diverso, perché nel caso delle anidridi il prodotto è il corrispondente ossiacido, vale a dire un composto ternario formato H, O e l’elemento non metallico.
CO2 + H2O = H2CO3 (anidride carbonica) (acido carbonico) |
|---|
SiO2 + 2H2O = H4SiO4 (anidride silicica) (acido silicico) |
N2O3 + H2O = 2 HNO2 (anidride nitrosa) (acido nitroso)N2O5 + H2O = 2 HNO3 (anidride nitrica) (acido nitrico) |
P4O10 + 6 H2O = 4 H3PO4 (anidride fosforica) (acido fosforico) |
SO3 + H2O = H2SO4 (anidride solforica) (acido solforico) |
Cl2O + H2O = 2 HClO (anidride ipoclorosa) (acido ipocloroso) |
Cl2O7 + H2O = 2 HClO4 (anidride perclorica) (acido perclorico) |
Alcuni ossidi covalenti non reagiscono con l’acqua: esempi notevoli sono CO e NO.
Ecco le strutture di alcuni ossidi covalenti:
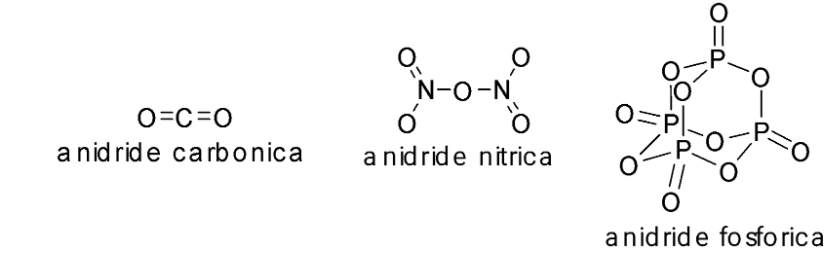
L’anidride fosforica, per la sua capacità di reagire prontamente con l’acqua, è usata come potente disidratante.