Il fissaidee
| Sito: | Federica Web Learning - LMS |
| Corso: | Scienze fisiche di base |
| Unit: | Il fissaidee |
| Stampato da: | Utente ospite |
| Data: | martedì, 26 agosto 2025, 20:24 |
Indice Unit
- 1. L’atomo: preistoria e storia antica
- 2. L’atomo: preistoria e storia antica
- 3. L’atomo: storia moderna /1
- 4. L’atomo: storia moderna /2
- 5. L’atomo: storia contemporanea
- 6. L’atomo oggi – parte prima: ricordi classici /1
- 7. L’atomo oggi – parte prima: ricordi classici /2
- 8. L’atomo oggi – parte prima: ricordi classici /3
- 9. Lo spin e la carta d’identità completa dell’atomo /1
- 10. Lo spin e la carta d’identità completa dell’atomo /2
- 11. Lo spin e la carta d’identità completa dell’atomo /3
- 12. L’atomo oggi – parte seconda: il modello quantistico /1
- 13. L’atomo oggi – parte seconda: il modello quantistico /2
- 14. La radioattività e il mondo subatomico /1
- 15. La radioattività e il mondo subatomico /2
- 16. La radioattività e il mondo subatomico /3
- 17. Interazione radiazione-materia e nascita della fisica quantistica
- 18. Dualismo onda-corpuscolo: il Giano bifronte della fisica
1. L’atomo: preistoria e storia antica

Nona tappa
“Come è fatto un atomo? Da cosa è costituito?” Dal punto di vista strettamente etimologico questa domanda è insensata: saprai già che “atomo” deriva da un termine greco che significa essenzialmente “indivisibile”. Pertanto, qualcosa che si chiama “indivisibile” non può essere “fatto” da altro che da sé stesso! Beh, in effetti questa è stata l’idea per più di due millenni, dai tempi di Democrito & Co. (V-IV sec a.C.) fino a meno di due secoli fa. Ancora ai tempi di Newton l’atomo era considerato come una sorta di rigida sferetta, piccolissima e indistruttibile. La visione comincia a cambiare (e a cambiare rapidamente) da metà Ottocento, allorché cominciano ad accumularsi una serie di risultati sperimentali che progressivamente portano a formulare l’ipotesi che la carica elettrica (già ben nota) fosse costituita da “granelli” discreti, portando infine alla scoperta di quello che oggi chiamiamo elettrone. Questa scoperta, come quasi tutte, fu in realtà un’impresa collettiva, ma non v’è dubbio che la “ciliegina sulla torta” fu ad opera del fisico britannico J.J. Thomson, che a fine Ottocento insieme ad altri suoi colleghi condusse alcuni esperimenti fondamentali, al punto da essere considerati la scoperta “ufficiale” dell’elettrone.
Per spostarti tra le pagine del fissaidee utilizza le frecce azzurre.2. L’atomo: preistoria e storia antica
“Come è fatto un atomo? Da cosa è costituito?” Dal punto di vista strettamente etimologico questa domanda è insensata: saprai già che “atomo” deriva da un termine greco che significa essenzialmente “indivisibile”. Pertanto, qualcosa che si chiama “indivisibile” non può essere “fatto” da altro che da sé stesso! Beh, in effetti questa è stata l’idea per più di due millenni, dai tempi di Democrito & Co. (V-IV sec a.C.) fino a meno di due secoli fa. Ancora ai tempi di Newton l’atomo era considerato come una sorta di rigida sferetta, piccolissima e indistruttibile. La visione comincia a cambiare (e a cambiare rapidamente) da metà Ottocento, allorché cominciano ad accumularsi una serie di risultati sperimentali che progressivamente portano a formulare l’ipotesi che la carica elettrica (già ben nota) fosse costituita da “granelli” discreti, portando infine alla scoperta di quello che oggi chiamiamo elettrone. Questa scoperta, come quasi tutte, fu in realtà un’impresa collettiva, ma non v’è dubbio che la “ciliegina sulla torta” fu ad opera del fisico britannico J.J. Thomson, che a fine Ottocento insieme ad altri suoi colleghi condusse alcuni esperimenti fondamentali, al punto da essere considerati la scoperta “ufficiale” dell’elettrone.
3. L’atomo: storia moderna /1
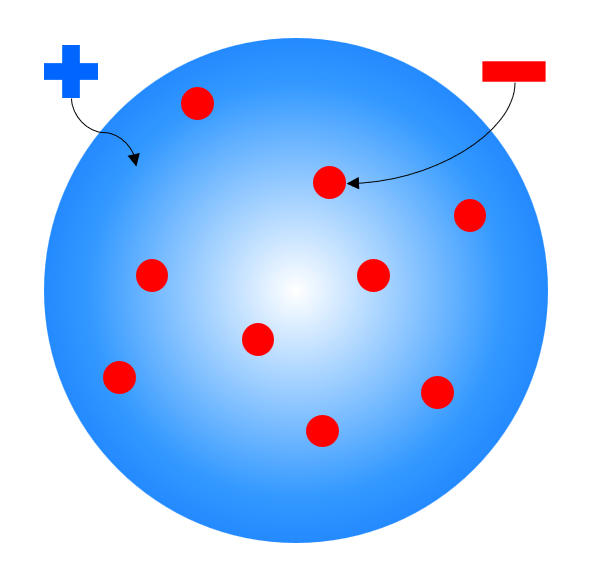
A fine Ottocento, dunque, per interpretare i risultati sperimentali sin lì accumulatisi, Thomson formulò un modello di atomo che prevedeva che l’unità costitutiva della materia fosse a sua volta costituita (perdendo quindi lo status di a-tomo!) da carica elettrica positiva distribuita in un volume sferico, disseminato qua e là di piccole particelle (gli elettroni) recanti carica negativa (vedi figura qui sotto). Un po’ come le uvette in un panettone, oppure i semini in un’anguria.
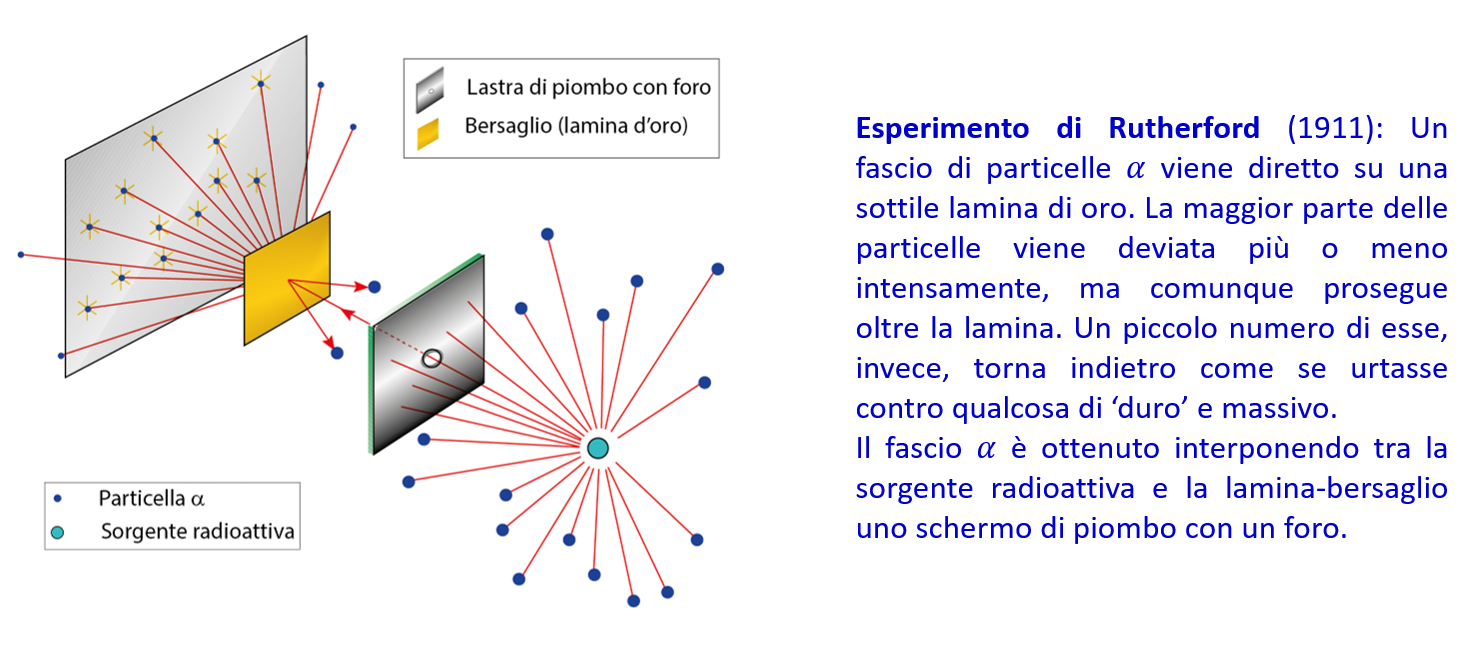
Questo modello fu messo in crisi dai risultati di un celebre esperimento condotto nel 1911 da Ernest Rutherford e collaboratori (illustrato nella figura) i cui esiti suggerivano chiaramente che nei mattoncini costituenti la materia (nello specifico l’oro) fossero presenti dei costituenti molto piccoli, ma con massa molto più grande di quella dell’elettrone, contro i quali le particelle di tanto in tanto urtavano, venendo così respinte dalla parte della direzione di provenienza.
4. L’atomo: storia moderna /2
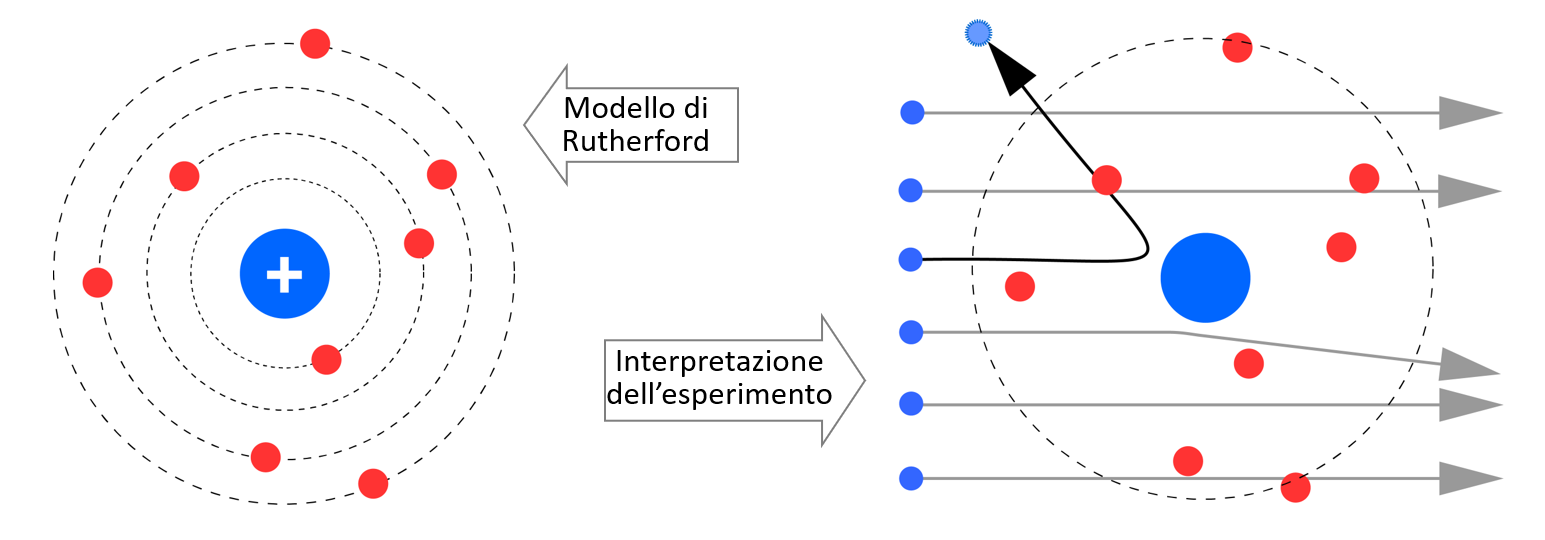
Per spiegare i risultati dell’esperimento, Rutherford ideò un nuovo modello dell’atomo, nel quale la carica elettrica positiva si trova concentrata in un massiccio nocciolo centrale (il nucleo) mentre gli elettroni di carica negativa sono situati tutto intorno secondo il familiare modello planetario. Questo modello, al contrario di quello di Thomson, spiega l’osservazione di particelle respinte verso la zona dalla quale provenivano: questo avviene quando la particella urta più o meno centralmente il nucleo.
Il modello planetario dell’atomo è stato introdotto per spiegare i risultati dell’esperimento di Rutherford, funzionando egregiamente a tale scopo. Tuttavia, il Metodo scientifico impone di sottoporre continuamente alla prova i modelli, prevedendo fenomeni sulla base di essi e confrontando le previsioni con i risultati degli esperimenti. E ben presto ci si rese conto che il modello atomico di Rutherford faceva clamorosamente cilecca su almeno due fronti nel confronto previsione-risultati.
Da un lato, era noto da tempo che ciascun elemento opportunamente stimolato emette onde elettromagnetiche (si dice che ‘irradia’) di certe ben definite lunghezze d’onda, e non di altre; tanto che l’insieme delle lunghezze d’onda della radiazione emessa da un certo elemento costituisce una vera e propria “impronta digitale” dell’elemento stesso (con terminologia corretta diremo che ogni elemento ha il suo caratteristico “spettro di emissione” che lo identifica in maniera pressoché univoca).
Dall’altro, la teoria elettromagnetica, formulata un cinquantennio prima da Maxwell, prevedeva che una carica elettrica in moto circolare, essendo accelerata (accelerazione centripeta), dovesse irraggiare onde elettromagnetiche, perdendo così energia. Alla luce di ciò, gli elettroni (negativi) orbitanti attorno al nucleo (positivo) avrebbero dovuto rapidamente cadere spiraleggiando verso il nucleo, ponendo fine all’esistenza dell’atomo come tale. L’evidente stabilità della materia che ci circonda smentisce perciò il modello planetario dell’atomo.
5. L’atomo: storia contemporanea
Una prima soluzione alle problematiche presentate dal modello atomico di Rutherford fu proposta dal fisico danese Niels Bohr nel 1913. Il modello di Bohr, che ebbe un grandioso successo nello spiegare gli spettri di emissione e assorbimento degli atomi, si basava su alcuni postulati che, in quanto tali, venivano assunti senza possibilità di spiegarli riconducendoli a qualcosa di più fondamentale. Solo nei due decenni successivi, con lo sviluppo della meccanica quantistica, i postulati di Bohr hanno trovato una “spiegazione” e attualmente possiamo considerarli come un’ottima approssimazione – nel caso di atomi semplici – di una teoria molto più complessa.
Orbene, le assunzioni fatte da Bohr – in particolare per l’atomo più semplice possibile, l’idrogeno – sono le seguenti:
- L’elettrone percorre traiettorie circolari intorno al protone (nucleo) grazie alla forza centripeta costituita dall’interazione coulombiana;
- Tra tutte le orbite possibili secondo la meccanica classica, ne esistono alcune sulle quali l’elettrone non irraggia radiazione elettromagnetica, e quindi il moto orbitale su tali orbite è stabile;
- L’elettrone può “saltare” tra le orbite stabili: a tali salti corrispondono le specifiche lunghezze della radiazione osservate negli spettri atomici.
6. L’atomo oggi – parte prima: ricordi classici /1
Il modello definitivo (per ora!) che abbiamo dell’atomo, ormai da quasi un secolo, è stato sviluppato nel quadro della meccanica quantistica. Quest’ultima è una teoria che ha dimostrato un enorme potere predittivo nei confronti di una vastissima gamma di fenomeni microscopici, e che pertanto è ampiamente consolidata e accettata. Naturalmente, la storia e la filosofia della scienza ci hanno preparato a non stupirci se prima o poi emergeranno dei risultati sperimentali che metteranno in crisi anche la meccanica quantistica!
La fisica classica ci ha abituati a individuare chiaramente due classi ben distinte di enti fisici e di fenomeni:
- Da un lato ci sono gli enti materiali, le particelle, caratterizzate dal fatto di avere una ben precisa localizzazione nello spazio e un altrettanto ben definito stato di moto (velocità, quantità di moto). Ad esempio, gli elettroni dei modelli atomici che abbiamo visto prima sono delle particelle puntiformi ben localizzate nello spazio, tanto che a essi vengono associate delle posizioni (modello di Thomson) e traiettorie (le orbite dei modelli di Rutherford e Bohr).
- L’altra classe di enti fisici classici è costituita dalle onde e dai fenomeni a esse connessi. A differenza delle particelle, le onde sono fenomeni diffusi nello spazio, piuttosto che localizzati in un singolo punto.
Orbene, una peculiarità della descrizione quantistica del mondo microscopico consiste nel fatto che si perde la distinzione netta tra i due tipi di comportamento citati (particellare o ondulatorio) specialmente nei fenomeni che avvengono a scala spaziale e di energia tipici dei fenomeni atomici. In questi casi, avviene che gli enti che classicamente eravamo abituati a considerare come particelle (ad esempio gli elettroni) finiscono col manifestare comportamenti tipicamente ondulatori. Viceversa, fenomeni che in fisica classica sono indiscutibilmente ondulatori (ad esempio le onde elettromagnetiche) danno luogo a fenomeni che si possono spiegare (e bene!) solo assumendo che tali onde in alcune circostanze si comportano come se fossero particelle. Per far riferimento a questa natura un po’ “ambigua” (o forse meglio “ambi-valente”) del mondo microscopico, i fisici hanno coniato la denominazione dualismo onda-corpuscolo.
7. L’atomo oggi – parte prima: ricordi classici /2
Ora siamo psicologicamente pronti (almeno un po’…) a rinunciare alla nostra tranquillizzante visione intuitiva macroscopica del mondo, e siamo quindi disposti ad accettare che possano esistere enti che sono contemporaneamente particelle e onde. Questa affermazione significa, ad esempio, che certi fenomeni che coinvolgono tali enti fisici si spiegano ammettendo che essi siano in un ben definito punto dello spazio, mentre altri fenomeni si comprendono ammettendo che tali enti siano “diffusi” in una certa regione spaziale.
Passiamo quindi alla descrizione del modello atomico attuale, che è basato fortemente sulla visione quantistica del mondo fisico. A tal fine è utile una considerazione preliminare. Come vedremo un po’ più avanti, il nucleo atomico è un “mondo a sé stante” rispetto agli elettroni, nel senso che l’energia che tiene insieme nel nucleo i suoi componenti è molti ordini di grandezza maggiore di quella che tiene gli elettroni legati al nucleo (è come se il nucleo, a fini pratici, fosse essenzialmente indivisibile, puntiforme e “duro” rispetto al comportamento degli elettroni). Pertanto, finché ci si interessa al comportamento degli atomi come entità chimiche definite (gli elementi), incluso il modo in cui ciascun elemento assorbe o emette radiazioni elettromagnetiche (cioè gli spettri di assorbimento o emissione), lo “stato” di un atomo coincide con lo “stato” dell’insieme dei suoi elettroni.
Il modello atomico oggi ampiamente accettato, in quanto confermato da clamorose e numerosissime evidenze sperimentali, è caratterizzato da due aspetti tipicamente quantistici:
- Gli elettroni negli atomi possono esistere solo in ben definiti “stati” e non in altri. Tali stati corrispondono ad alcuni valori discreti di grandezze fisiche come l’energia e il momento angolare, nel senso che solo tali valori sono “permessi”. Valori differenti, pur essendo possibili secondo la fisica classica, non lo sono nel quadro quantistico. Questa caratteristica è già presente nel modello di Bohr, laddove alle orbite permesse corrispondono valori ben precisi del momento angolare e dell’energia.
- Gli elettroni dell’atomo non sono più considerati come “palline” ben localizzate nello spazio in ogni momento. Piuttosto, ciascuno di essi si comporta come se fosse nello stesso momento distribuito in una regione più o meno ampia del volume intorno al nucleo (la “nuvola elettronica”). Per siffatti elettroni non è più appropriato il concetto di “orbita” (ancora presente nel modello di Bhor), che viene quindi sostituito da quello di “orbitale”.
8. L’atomo oggi – parte prima: ricordi classici /3
Una tappa cruciale nel passaggio dal modello atomico di Bohr (nel quale gli elettroni sono ancora pur sempre particelle) a quello pienamente quantistico (che considera invece gli elettroni come descritti da uno strano oggetto matematico detto “funzione d’onda”), è costituito da una estensione del modello di Bohr, elaborata da Arnold Sommerfeld poco tempo dopo, col principale intento di includere la possibilità che gli elettroni siano su orbite ellittiche (gli elettroni di Bohr potevano avere solo orbite circolari). Conviene citare il modello di Sommerfeld, poiché la terminologia da egli introdotta è sostanzialmente quella attuale, sia pur con un significato fisico a tratti un po’ differente.
Orbene, Bohr aveva postulato che il momento angolare degli elettroni fosse quantizzato; cioè che essi potessero occupare solo orbite circolari di raggio specifico, e quindi di energia ben definita. Questa condizione, che viene espressa mediante un numero \( n \) detto numero quantico principale, permane nel modello di Sommerfeld, che però ammette anche la possibilità di orbite ellittiche. A tal fine viene introdotto un ulteriore parametro \( l \) detto numero quantico orbitale. Per un fissato valore del numero quantico principale, \( l \) può assumere i valori interi: \( 0, 1, …, n-1 \). Questo significa che per un fissato valore permesso dell’energia (definito da \( n \)) all’elettrone è permesso trovarsi in uno degli \( n-1 \) stati, distinti per il momento angolare (NOTA: nel modello di Bohr, fissare l’energia equivale a fissare il momento angolare, dal momento che le uniche traiettorie previste sono quelle circolari).
Ricordiamo che la principale tipologia di esperimenti alla base della verifica della adeguatezza dei modelli atomici era costituita (e anche oggi ha grande importanza) dalla determinazione delle lunghezze d’onda della radiazione elettromagnetica emessa o assorbita da un atomo; cioè, la determinazione degli spettri di assorbimento e di emissione. Orbene, qualche tempo dopo la formulazione del modello di Sommerfeld irruppero sulla scena nuovi risultati sperimentali che non trovavano un’adeguata interpretazione alla luce della versione-base di tale modello. In particolare si scoprì che allorché gli atomi di un gas venivano posti in un campo magnetico sufficientemente intenso, alcune delle sue righe spettrali (la cui posizione in lunghezza d’onda è determinata dalla differenza di energia tra specifici livelli energetici degli elettroni dell’atomo) si suddividevano in “sotto-righe” meno intense. Questo fenomeno (denominato effetto Zeeman, dal nome del suo scopritore) era indicativo del fatto che il campo magnetico provocava una suddivisione dei livelli energetici ammessi in un certo numero di sotto-livelli (il tecnicismo anglofono per tale fenomeno è “splitting dei livelli”). Per interpretare l’effetto Zeeman si pensò di introdurre nel modello atomico un ulteriore numero quantico \( m_l \), detto numero quantico magnetico, il quale – per un fissato valore \( l \) del numero quantico orbitale – potesse assumere i valori interi compresi tra \( -l \) e \( l \), cioè \( -l≤m_l≤l \).
9. Lo spin e la carta d’identità completa dell’atomo /1
Con la scoperta dell’effetto Zeeman e la conseguente introduzione del numero quantico magnetico, la storia non era ancora finita! Infatti, esperimenti di spettroscopia molto accurati e in grado di distinguere righe spettrali anche molto vicine tra loro (i fisici si riferiscono a questa caratteristica parlando di “alta risoluzione in lunghezza d’onda”) misero in evidenza che molte delle righe spettrali erano in realtà costituite da due righe vicinissime tra loro, anche in assenza di campo magnetico (questa caratteristica degli spettri atomici viene denominata struttura fine). Questa ulteriore evidenza sperimentale trovò adeguata interpretazione dopo che, nel 1925, i fisici Uhlenbeck e Goudsmit introdussero un ulteriore numero quantico detto di spin. Secondo tale ipotesi, lo stato di un dato elettrone di un atomo, caratterizzato dai tre valori dei numeri quantici \( n \), \( l \) e \( m_l \), era ulteriormente specificato da questo nuovo numero quantico \( m_S \) che può assumere uno dei due valori \( -1/2 \) oppure \( +1/2 \).
La moderna visione dell’atomo è dunque basata sull’idea (ampiamente confermata dagli esperimenti) che lo “stato” di un elettrone quando fa parte di un atomo è descritto dai numeri quantici che abbiamo ricordato. Quindi lo stato di un atomo nel suo complesso è definito dall’insieme dei valori dei numeri quantici dei suoi elettroni. È un po’ come se i numeri quantici fossero le “voci” presenti sulla “carta d’identità” di un elettrone!
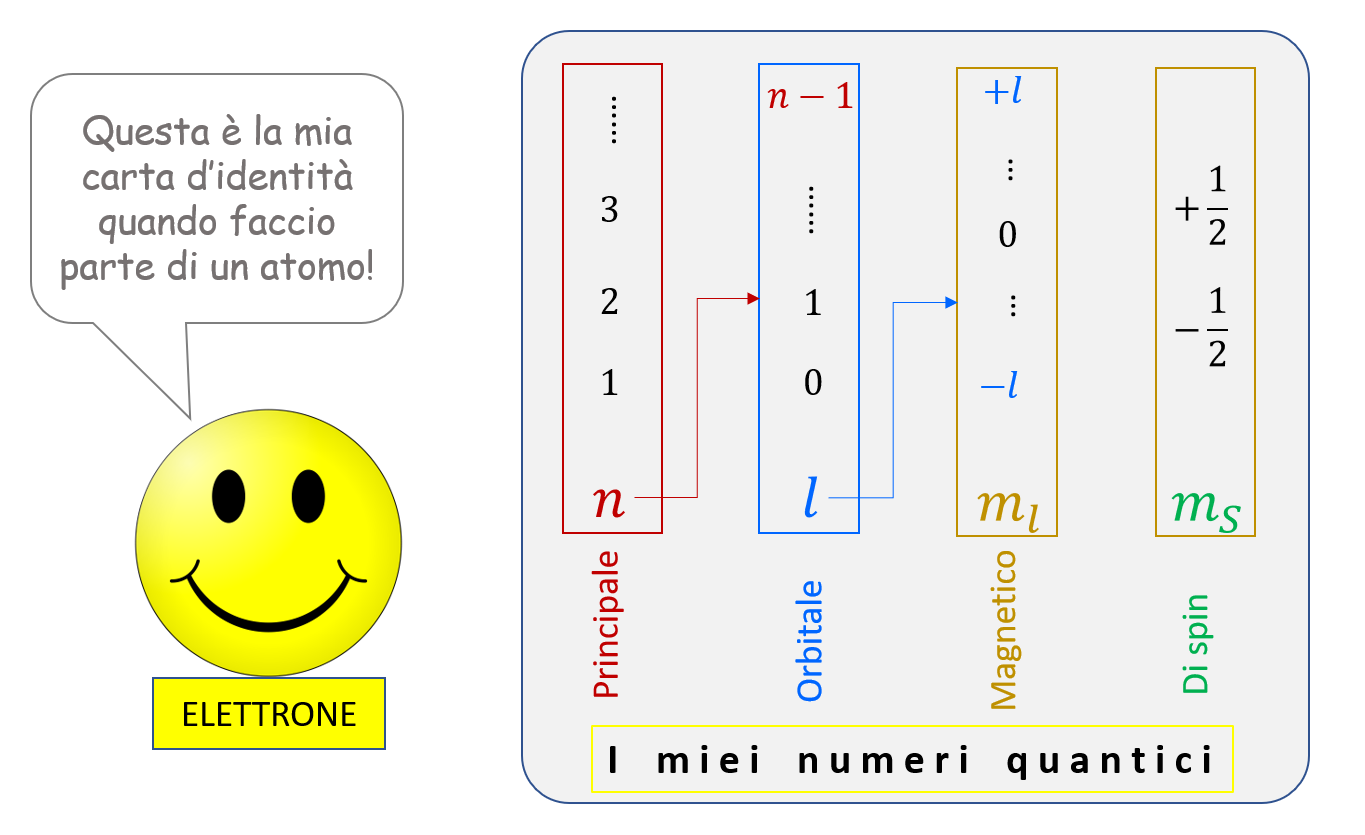
10. Lo spin e la carta d’identità completa dell’atomo /2
Avrete notato che il numero quantico di spin viene indicato con il simbolo \( m_S \) che, al pari di quello utilizzato per il numero quantico magnetico, ricorda – appunto – il ruolo del campo magnetico. Questo dettaglio potrebbe apparire strano, dato che lo spin spiega una caratteristica che gli spettri atomici presentano anche quando gli atomi non sono in presenza di un campo magnetico!
Come vedremo fra poco, l’introduzione dei numeri quantici, fatta su base quasi empirica dai pionieri dei modelli atomici, trova giustificazione e coerenza totale nell’ambito della meccanica quantistica, la quale si sviluppata nei primi tre decenni del Novecento intrecciandosi con la progressiva definizione dei modelli atomici. Orbene, una delle caratteristiche del mondo quantistico è che la logica sulla quale è basato ci costringe a rinunciare in larga parte al nostro innato desiderio di farci un’idea intuitiva dei fenomeni nei quali ci imbattiamo. Questa premessa è utile per mettere nella giusta prospettiva l’interpretazione che ora vedremo circa lo spin e il meccanismo col quale esso è in qualche modo connesso al campo magnetico nel determinare la struttura fine degli spettri atomici.
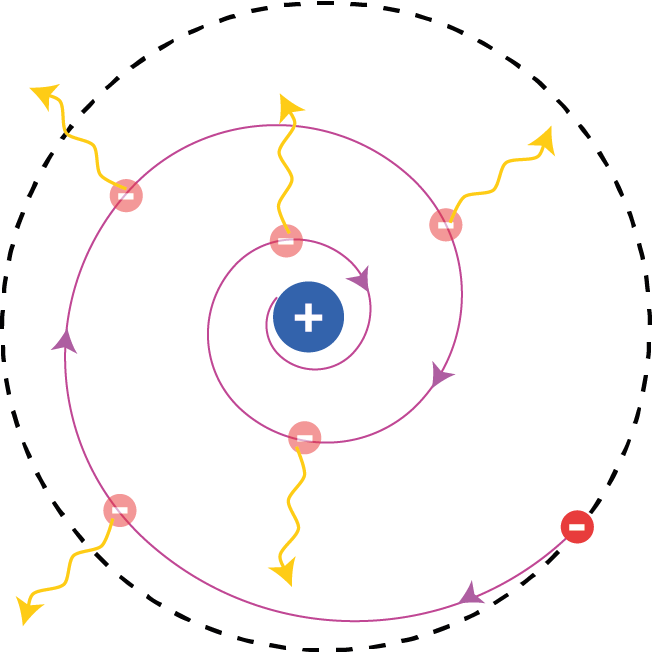
Una visione intuitiva dello spin dell’elettrone (forse un tantino naïf, ma che comunque consente di comprendere qualitativamente alcuni dei fenomeni a esso connessi) è di pensare a tale particella come una minuscola sferetta carica che ruota su sé stessa. In tal modo è come se si avessero tante minuscole spirette di corrente elettrica coassiali, il cui effetto complessivo è di far sì che l’elettrone si comporti come un minuscolo magnetino, la cui polarità dipende dal verso di “rotazione”, cioè dal segno del numero quantico di spin. Sottolineiamo ancora una volta: questa descrizione è solo un’utile analogia che rende conto di alcuni aspetti dello spin, e non va presa alla lettera.
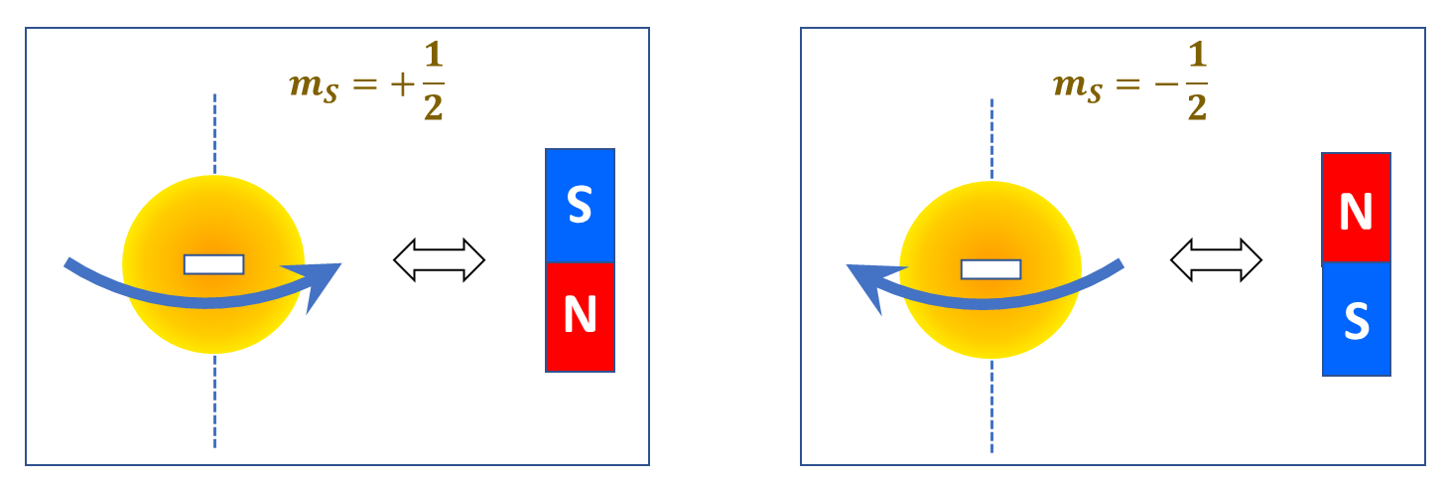
11. Lo spin e la carta d’identità completa dell’atomo /3
Lo spin è quindi in qualche modo indicativo del fatto che l’elettrone “ruota” su sé stesso, in tal modo assumendo le caratteristiche di un minuscolo magnetino. D’altra parte, secondo la visione “planetaria” dell’atomo, l’elettrone “gira” anche intorno al nucleo. Orbene, una carica elettrica che percorre un’orbita chiusa corrisponde a tutti gli effetti a una minuscola spiretta percorsa da corrente elettrica (coincidente con l’orbita, e quindi centrata sul nucleo). Anche questa minuscola “corrente elettrica orbitale” dà luogo a un campo magnetico, il quale a sua volta agisce sull’elettrone, in quanto “magnetino” a causa dello spin! Insomma, è come se l’elettrone interpretasse contemporaneamente due parti in commedia: genera un campo magnetico (in quanto carica elettrica orbitante) e ne sente esso stesso gli effetti (in quanto carica elettrica ruotante su sé stessa)! Se questo fatto vi sembra strano, siete sulla via giusta via per cominciare a conoscere il mondo quantistico, dato che – come abbiamo prima osservato – per avvicinarci a tale mondo dobbiamo progressivamente rinunciare al nostro desiderio innato, davanti a fenomeni nuovi, di trovare per essi una corrispondenza con la nostra concezione intuitiva del mondo fisico.
Alla luce del quadro delineato, dovrebbe ora risultare meno strano che il numero quantico di spin venga indicato con un simbolo, \( m_S \), che richiama l’aggettivo “magnetico”.
12. L’atomo oggi – parte seconda: il modello quantistico /1
Nelle precedenti sezioni abbiamo esaminato la travagliata evoluzione del modello dell’atomo, dalla visione puramente classica (particelle elettricamente negative che orbitano attorno a un nucleo elettricamente positivo) a quella che ha introdotto una serie di “etichette” descrittive dello stato degli elettroni (i vari numeri quantici) per dar conto delle “stranezze” osservate negli esperimenti con gli spettri atomici (il modello di Sommerfeld e successive modifiche). Orbene, il modello completo che abbiamo riassunto qualche scheda fa con la “carta d’identità” dell’elettrone, è stato il risultato di una serie di successive modifiche e ampliamenti, introdotti in maniera più o meno empirica per spiegare i fenomeni osservati; senza però che ci fosse un quadro interpretativo unitario (una teoria) che giustificasse pienamente le caratteristiche via via introdotte. In altri termini, l’introduzione di concetti e caratteristiche nuove (come ad esempio il fatto che gli elettroni nell’atomo potessero esistere solo in alcuni “stati” ben definiti e non in altri; oppure che l’elettrone si comportasse come una trottolina con sole due possibilità di “girare”) venne fatta su base quasi “empirica”, semplicemente perché tali idee “funzionavano” nell’interpretazione dei risultati sperimentali e nella previsione di nuovi risultati che venivano puntualmente osservati. Per i fisici, però, tale stato di cose era profondamente insoddisfacente; tanto che, mentre gli edificatori del moderno edificio atomico progressivamente mettevano a punto il modello, altri fisici (molti dei quali appartenenti anche al citato gruppo degli edificatori) costruivano una visione organica e coerente del mondo fisico, su solide basi matematiche, che oggi chiamiamo Meccanica quantistica. Queste due imprese intellettuali, basate su altrettanto notevoli imprese sperimentali, giunsero a compimento all’incirca nel terzo decennio del Novecento, allorché il modello dell’atomo che abbiamo descritto (basato sull’introduzione di ipotesi talvolta “ad hoc”) trovò conferma e giustificazione organica nel quadro della neonata Meccanica quantistica.
13. L’atomo oggi – parte seconda: il modello quantistico /2
La visione pienamente quantistica dell’atomo ci porta ad abbandonare alcuni concetti classici ai quali siamo profondamente affezionati, fra i quali il fatto che una particella puntiforme possa essere sempre ben localizzata nello spazio e quello, connesso al precedente, che ci porta a pensare che una particella in moto percorra un’orbita ben definita, descritta da un ente geometrico familiare quale una circonferenza o un’ellisse. Infatti, laddove la fisica classica descrive le particelle per mezzo di variabili che assumono valori ben definiti (posizione e velocità), nel quadro quantistico ciascuna particella è descritta da un oggetto matematico detto funzione d’onda, che racchiude tutta l’informazione che è possibile ottenere sperimentalmente sulla situazione della particella. Tale funzione (i cui valori, per inciso, sono numeri complessi) descrive lo stato quantistico di una particella da vari punti di vista. Quello forse intuitivamente più vicino al concetto classico di particella è il seguente: il valore medio del modulo della funzione d’onda in una piccola regione di spazio, moltiplicato per il volume di tale regione, fornisce la probabilità che effettuando una misura la particella venga ivi trovata. Questo carattere probabilistico (in contrapposizione a quello deterministico della fisica classica) è onnipresente nella descrizione quantistica degli oggetti fisici.
Nel quadro descritto, il concetto di orbita presente nei primi modelli atomici (anche in quello di Bohr) viene sostituito da quello di “orbitale”. Certamente ti saranno familiari le tipiche forme di orbitali mostrate in figura: le diverse forme corrispondono a differenti valori dei numeri quantici \( n \), \( l \) e \( m_l \), mentre \( m_S \) non è legato alla forma dell’orbitale: i due valori che tale numero quantico può assumere fanno sì che in un dato orbitale (individuato da una terna di valori dei restanti tre numeri quantici) possano trovarvisi fino a due elettroni, e in tal caso avranno l’uno \( m_S=-1/2 \) e l’altro \( m_S=+1/2 \): questa condizione è una delle molteplici conseguenze di un importante principio della meccanica quantistica formulato da Wolfgang Pauli, il principio di esclusione.
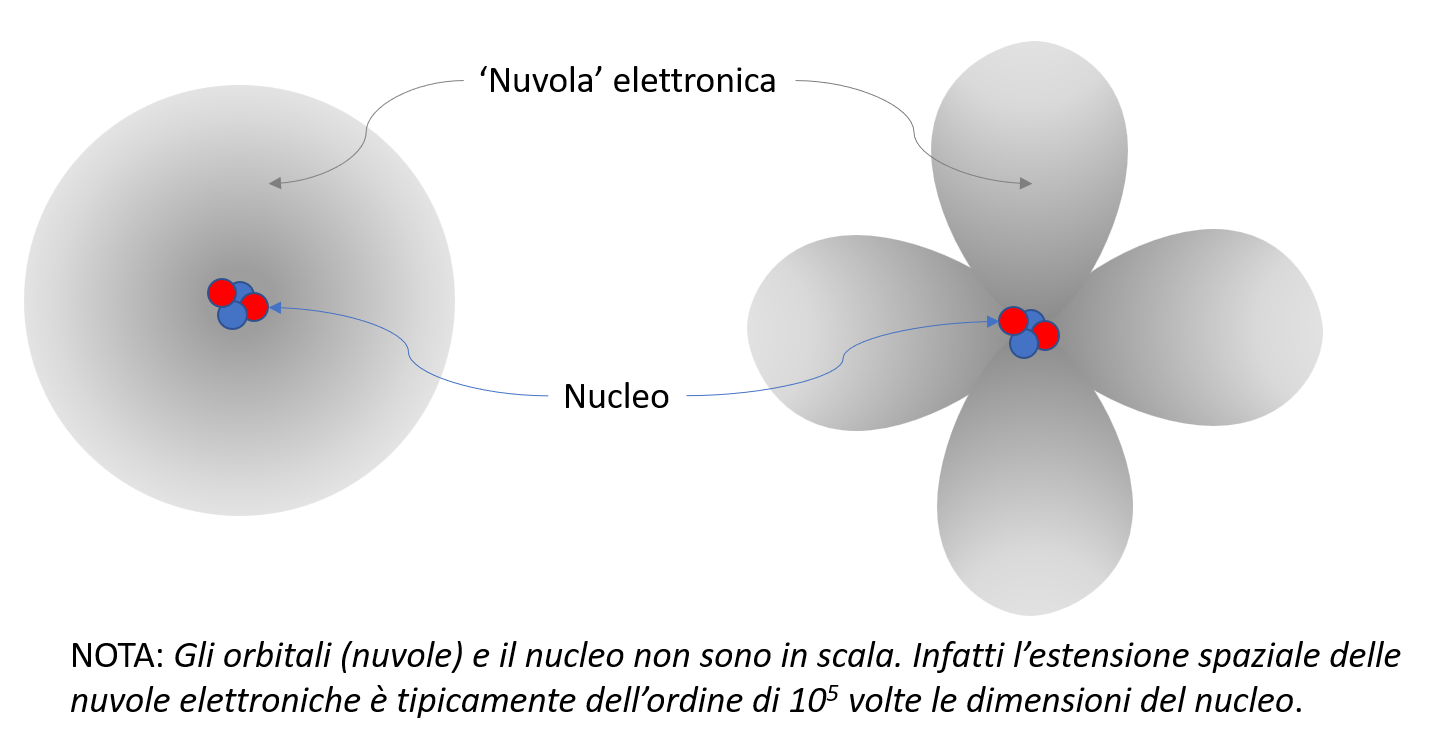
Conviene osservare che il termine “orbitale” è, per motivi storici, evocativo del termine “orbita”; tuttavia l’orbitale NON è da intendere come una sorta di “orbita tridimensionale”, ma rappresenta visivamente la distribuzione spaziale della probabilità che l’elettrone descritto da quell’orbitale si trovi in una certa regione dello spazio: più la nuvoletta è “densa” in quella regione, maggiore è la probabilità di trovarci l’elettrone. In particolare, l’orbitale non è un insieme di orbite molto fitte che si confondono tra loro.
14. La radioattività e il mondo subatomico /1
La scoperta a fine Ottocento del fenomeno della radioattività segna in pratica la nascita della fisica nucleare, il cui “primo vagito” può essere ragionevolmente datato 1896, allorché il fisico francese Henri Becquerel scopre la radioattività naturale dei composti dell’uranio. Naturalmente all’epoca non si aveva idea del fatto che questo fenomeno avesse origine dal nucleo atomico, semplicemente perché l’esistenza di questo ultimo non era nota (l’esperimento di Rutherford, che abbiamo illustrato in precedenza, è del 1911). Peraltro, Rutherford e collaboratori, oltre ad avanzare l’ipotesi che la massa e la carica positiva dell’atomo fossero concentrate in un volume ridottissimo rispetto alle dimensioni atomiche, mediante una serie di ulteriori esperimenti studiarono i diversi tipi di radiazioni emanate, giungendo a classificarle in tre tipologie (alfa, beta, gamma), distinte in base alla carica elettrica e alla capacità di penetrazione nella materia. È da segnalare, inoltre, che gli esperimenti condotti in questo periodo di inizio secolo portarono a individuare un nuovo tipo di forza, denominata forza nucleare (successivamente si rese necessario aggiungere l’aggettivo forte), dal comportamento completamente diverso da quelle sino ad allora note (elettromagnetica e gravitazionale). Tale forza si mostrava dominante sulle altre a distanze minori o uguali di circa \( 10^{-14} \, m \), mentre a distanze maggiori “crollava” improvvisamente.
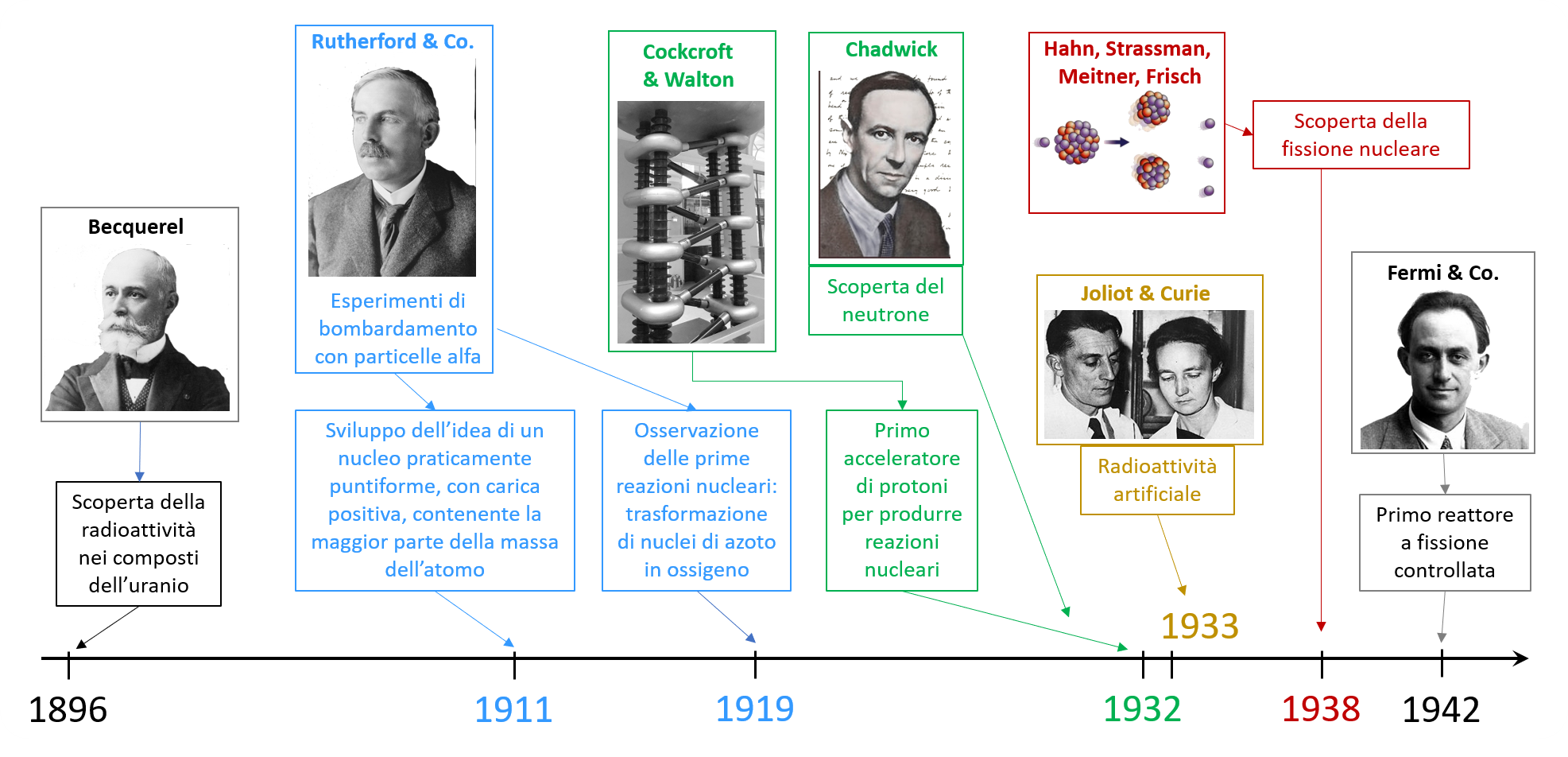
La scoperta del nucleo e della sua struttura si intreccia strettamente con l’evoluzione delle conoscenze sulla costituzione dell’atomo, come si può facilmente comprendere confrontando le date e le scoperte riguardanti quest’ultimo con le principali tappe dello sviluppo della fisica nucleare riassunte in figura:
15. La radioattività e il mondo subatomico /2
All’inizio degli anni Quaranta del Novecento le idee sulla struttura del nucleo, oltre che dell’atomo, erano essenzialmente complete (in relazione a quelle odierne), anche se basate su ipotesi che solo nei decenni successivi hanno trovato “spiegazione” alla luce di teorie più ampie e approfondite. In particolare, i costituenti del nucleo (protoni e neutroni) erano considerati particelle puntiformi e indivisibili, in grado di interagire mediante la forza nucleare forte, di intensità talmente elevata a piccola distanza da contrastare ampiamente l’effetto repulsivo tra i protoni dovuto alla loro carica elettrica. Tale modello del nucleo è compatibile con quello contemporaneo, salvo il fatto (non trascurabile, per la verità) che protoni e neutroni non sono più ritenuti costituenti ultimi, ma sono a loro volta formati da mattoncini ancora più piccoli denominati quark. In ogni caso, in questa nostra panoramica della fisica nucleare ci fermiamo al livello di descrizione immediatamente sub-nucleare, non occupandoci dell’ultrastruttura dei costituenti del nucleo.
Tutti i nuclei atomici sono costituiti da un certo numero di protoni e neutroni (collettivamente denominati nucleoni), salvo quello dell’elemento più leggero, l’idrogeno, che è costituito da un solo protone. Ciascun nucleo è identificato in maniera univoca da due numeri: quello dei protoni, detto numero atomico e indicato con la lettera Z, e quello complessivo dei nucleoni, detto numero di massa e indicato con A. Naturalmente il numero di neutroni è dato da N=A-Z. Il nucleo dell’atomo di un dato elemento chimico di simbolo X è indicato con \( ^A _Z X \). Così, ad esempio \( ^{31} _{15} P \) indica il nucleo dell’atomo di fosforo costituito da 15 protoni e 16 neutroni. Ricordiamo che l’identità chimica di un elemento è determinata dal numero di protoni nel nucleo (dato che questo a sua volta determina il numero di elettroni dell’atomo nello stato neutro). In natura però accade che di un dato elemento siano presenti differenti “versioni” (dette isotopi dell’elemento) aventi tutte lo stesso valore di Z, ma differenti valori di A. Ad esempio, dell’ossigeno esistono tre isotopi stabili, aventi tutti lo stesso numero di protoni (8), ma differente numero di neutroni (rispettivamente 8, 9 e 10): \( ^{16}_{8} O, \, ^{17}_8 O, \, ^{18}_8 O \).
16. La radioattività e il mondo subatomico /3
I diversi isotopi di un dato elemento non sono ugualmente abbondanti in natura; ad esempio, se prendiamo a caso 10.000 atomi di ossigeno, tra i loro nuclei ne troveremo 9976 di tipo \( ^{16}O \), 20 di tipo \( ^{18}O \) e solo 4 di tipo \( ^{17}O \). Si dice che gli isotopi hanno differente abbondanza. Osserviamo che nei precedenti simboli per gli isotopi dell’ossigeno abbiamo omesso l’indicazione del numero atomico (il pedice in basso a sinistra del simbolo). Infatti, poiché tale numero è univocamente individuato dal simbolo chimico, in genere si omette al fine di rendere più semplice la notazione. Ciascun isotopo di un dato elemento può essere stabile oppure instabile. In questo secondo caso il nucleo “vive” solo per un certo intervallo di tempo, dopodiché decade, cioè si trasforma spontaneamente nel nucleo di un diverso elemento. Questa trasformazione, che è uno dei meccanismi che dà luogo al fenomeno della radioattività naturale, può avvenire per varie ragioni. Ad esempio, l’isotopo del carbonio \( ^{14}C \) si trasforma spontaneamente in azoto \( ^{14}N \) a causa del fatto che uno degli 8 neutroni del \( ^{14}C \) si trasforma in un protone e in un elettrone (più, in realtà, un’elusiva particella leggerissima detta antineutrino, della quale però qui non parleremo oltre). In tal modo il nucleo iniziale di carbonio (6 protoni) si ritrova con 7 protoni, diventando quindi azoto.
Il meccanismo di trasformazione che abbiamo descritto è detto decadimento beta. Tale denominazione deriva dalla storia della scoperta della radioattività. Infatti, allorché un neutrone si trasforma, il protone risultante rimane a far parte del (nuovo) nucleo, mentre l’elettrone abbandona il nucleo stesso sotto forma di radiazione caratterizzata da carica elettrica negativa. Quando tale radiazione fu scoperta (oltre un decennio prima del neutrone), in assenza di informazioni circa la sua reale natura, fu denominata radiazione beta. Successivamente si comprese che essa è costituita da elettroni derivanti dal decadimento dei neutroni, così come le radiazioni alfa di Rutherford consistono di nuclei \( ^4He \) . Tuttavia la precedente denominazione rimase in uso. Lo studio del decadimento beta riveste un’enorme importanza anche dal punto di vista storico, dal momento che lo sviluppo di una teoria che lo spiegasse portò all’individuazione dell’ultima (per ora) interazione fondamentale presente in natura, l’interazione (nucleare) debole, ad opera principalmente di Enrico Fermi.
17. Interazione radiazione-materia e nascita della fisica quantistica
Nelle precedenti sezioni abbiamo avuto modo di vedere come nei primi decenni del Novecento si sono sviluppate le idee sulla costituzione dell’atomo, a partire da evidenze sperimentali che risultavano inspiegabili nel quadro della fisica classica (cioè la meccanica newtoniana e l’elettromagnetismo sintetizzato da Maxwell nelle sue quattro celebri equazioni). In effetti la problematica era di più ampia portata in quanto, a cavallo tra Ottocento e Novecento, si era accumulata una serie di risultati di esperimenti che metteva in crisi il modello sino ad allora accettato della interazione tra le onde elettromagnetiche e la materia, anche questo basato sulle leggi della fisica classica. Dal 1865, anno in cui Maxwell pubblicò la sua teoria dell’elettromagnetismo, cominciò una serie di esperimenti volti a verificarne le previsioni; in particolare quelle relative all’esistenza delle onde elettromagnetiche. Questi esperimenti (a opera di Hertz, Hallwachs, Lenard) portarono come “sottoprodotto” alla scoperta dell’effetto fotoelettrico. L’esigenza di spiegare tale fenomeno, le cui caratteristiche non trovavano adeguata spiegazione nell’ambito della fisica classica, portò Einstein nel 1905 a formulare una teoria dell’effetto fotoelettrico basata sull’assunto che la luce, nell’interazione con gli elettroni di un metallo, si comporti come se fosse costituita non da onde, ma da “pacchetti indivisibili” (successivamente denominati fotoni) ciascuno avente energia \( E=h \nu \) , essendo \( h=6.6×10^{-34}Js \) una costante detta di Planck e \( \nu \) la frequenza della luce considerata come onda elettromagnetica.
In effetti l’idea che lo scambio di energia tra radiazione elettromagnetica e materia avvenisse in maniera “discreta” (termine qui utilizzato come contrario di “continua”) era stata introdotta un lustro prima, nel 1900, da Max Planck, al fine di spiegare le caratteristiche osservate in relazione alla radiazione emessa (e assorbita) da un corpo a causa della sua temperatura più o meno elevata (ad esempio un pezzo di ferro reso incandescente). L’inspiegabilità di tali caratteristiche nell’ambito della teoria classica dell’interazione radiazione-materia è nota come problema del corpo nero. Planck ipotizzò che sulla superficie del corpo ci fossero una miriade di piccoli oscillatori elettricamente carichi (gli elettroni, scoperti pochi anni prima da Thomson) che interagivano con la radiazione, assorbendola ed emettendola. Fin qui niente di rivoluzionario… anche per il 1900. Il colpaccio di genio Planck lo ebbe ipotizzando che ciascuno di tali microscopici oscillatori potesse assumere non qualunque valore di energia compatibile con i suoi parametri, ma solo alcuni specifici valori del tipo \( E_n=nhf \), dove \( f \) è la frequenza caratteristica di vibrazione libera dell’oscillatore (pensiamo ad esempio a un sistema massa-molla) e n può essere un qualunque intero positivo. In altri termini, Planck ipotizzò che l’energia degli oscillatori fosse quantizzata, cioè potesse variare solo sotto forma di multipli di un “pacchetto base”.
L’ipotesi di Planck circa la quantizzazione dell’energia degli oscillatori (lato materia, dunque) è concettualmente molto diversa da quella di Einstein circa la quantizzazione dell’energia della radiazione. Tuttavia, poiché gli effetti di queste presunte quantizzazioni erano osservabili solo nel momento in cui la radiazione interagiva con la materia, entrambe portavano all’idea che lo scambio energetico radiazione-materia fosse quantizzato. I “pacchetti” di questo scambio sono quelli che oggi chiamiamo fotoni. A tal proposito è opportuno richiamare che questa denominazione non fu introdotta da nessuno dei due, ma venne coniata durante gli anni Venti del secolo ed entrò nel lessico scientifico ufficiale solo nel 1927, anno in cui venne attribuito il premio Nobel ad Arthur Compton per la scoperta di un fenomeno che dimostrò in maniera inconfutabile la natura quantizzata della luce nella sua interazione con la materia. Tale fenomeno è oggi noto come effetto Compton. A titolo di curiosità etimologica, ricordiamo che quasi unanimemente si ritiene che a coniare il termine fotone sia stato nel 1926 non un fisico, ma un chimico (o meglio, un chimico-fisico): l’americano Gilbert Lewis, lo stesso che propose l’idea di legame chimico covalente.
18. Dualismo onda-corpuscolo: il Giano bifronte della fisica
Nelle precedenti sezioni abbiamo richiamato una delle colonne concettuali della fisica quantistica: l’idea che la radiazione elettromagnetica (cioè un’entità fisica di natura strettamente ondulatoria nella fisica classica: le onde elettromagnetiche) in alcune circostanze si comporta come se fosse invece costituita da corpuscoli, i fotoni. Esiste quindi un’entità fisica per descrivere la quale occorre utilizzare talvolta il modello corpuscolare, talaltra quello ondulatorio. A questo punto ci si potrebbe chiedere se questa sorta di “ambivalenza” riguardi anche altri enti fisici; per esempio quelli che ordinariamente si comportano (e quindi sono descritti) come particelle, come gli elettroni. Questa domanda se la pose un giovane fisico francese, Louis de Broglie che, nella sua tesi di dottorato nel 1924, avanzò l’ipotesi che la duplice natura (particellare e ondulatoria) fosse caratteristica anche degli oggetti fisici usualmente considerati come corpuscoli. In particolare, partendo dalla relazione che lega lunghezza d’onda, energia e quantità di moto (impulso) nel caso dei fotoni, per analogia ipotizzò che a una particella materiale corrispondesse un’onda di lunghezza d’onda \( \lambda = h/p \) dove \( p \) è la quantità di moto della particella e \( h \) come al solito è la costante di Planck. Questa ipotesi aveva conseguenze molto curiose. Infatti, se le particelle – per esempio gli elettroni – potevano comportarsi come onde, allora avrebbero potuto dar luogo a fenomeni caratteristici delle onde, come la diffrazione, fino ad allora considerati del tutto estranei alla materia. In effetti, pochi anni dopo la pubblicazione dell’ipotesi di de Broglie, nel 1927 due fisici statunitensi, Davisson e Germer, osservarono fenomeni di diffrazione con gli elettroni che consentirono di misurarne la lunghezza d’onda, confermando quanto previsto da de Broglie. È curioso ricordare che i due non stavano cercando di verificare la supposta natura ondulatoria dell’elettrone. Essi stavano smanettando con fasci di elettroni per altri motivi, allorché per un caso fortuito si imbatterono in un fenomeno inspiegabile, se non alla luce dell’ipotesi di de Broglie. Certo, c’entrò il caso… ma soprattutto la capacità dei due sperimentatori di riconoscere la vera natura di quello che altri avrebbero potuto scartare etichettandolo magari come un errore nell’esperimento. Come diceva Louis Pasteur: “la fortuna aiuta le menti preparate”!
La duplice natura della luce e delle particelle, nota come dualismo onda-corpuscolo, è uno degli aspetti della fisica quantistica più “difficili da digerire” sul piano intuitivo. Il nostro armamentario di categorie mentali, cui attingiamo per farci un’idea intuitiva della realtà, si è sviluppato sulla base delle nostre esperienze sensoriali, che sono essenzialmente macroscopiche. Per cui non deve stupire più di tanto che alla scala atomica e sub-atomica (della quale non abbiamo mai avuto, né verosimilmente avremo, esperienza sensoriale diretta) le cose vadano in modi incompatibili con la intuizione. Peraltro, la difficoltà a accettare alcuni aspetti della descrizione quantistica della natura era ben presente anche tra coloro che tale descrizione hanno contribuito a creare, a cominciare dallo stesso Einstein. A questo proposito vogliamo chiudere il nostro lungo – e speriamo piacevole – viaggio nel mondo della fisica con la citazione di un verso da una poesia scherzosa composta dal fisico Enrico Persico, amico e collega di Enrico Fermi, nonché uno dei principali fisici quantistici italiani dell’epoca. Il verso è il seguente:
Credon poi, con fé profonda
Cui s'inchina la ragion,
Che la luce è corpo ed onda,
Onda e corpo è l'elettron.
Coloro cui si riferiva Persico (cioè color che “credono con fede profonda”) sono i componenti della “scuola” di Fermi (incluso sé stesso!), cioè il gruppo di giovani fisici teorici che tanto contribuì alle prime elaborazioni e applicazioni della fisica quantistica. Naturalmente il riferimento alla “fede” è ironico, dato che la fisica quantistica già allora aveva solide basi matematiche e, soprattutto, era stata confermata da numerosissime prove sperimentali. Tuttavia è indicativo della difficoltà di accettare pienamente il fatto che “la luce è corpo e onda”, e parimenti lo è l’elettrone, persino da parte di coloro che tale quadro concettuale avevano elaborato!