Fissaidee 1
| Site: | Federica Web Learning - LMS |
| Course: | Scienze chimiche di base |
| Unit: | Fissaidee 1 |
| Printed by: | Utente ospite |
| Date: | Tuesday, 26 August 2025, 7:01 PM |
Table of contents
- 1. Il mondo degli atomi e delle molecole
- 2. La teoria atomica di Dalton
- 3. Elementi, sostanze semplici e sostanze composte
- 4. Masse atomiche relative
- 5. Masse atomiche assolute
- 6. Masse molecolari
- 7. La tavola periodica degli elementi
- 8. La tavola periodica degli elementi moderna
- 9. Le formule chimiche
- 10. Formula minima
- 11. Molecole, ioni, formula minima e formula molecolare
- 12. Formula molecolare
1. Il mondo degli atomi e delle molecole
Oggi sappiamo che tutta la materia che ci circonda è costituita da atomi. Le galassie e i pianeti
gli oceani e i deserti

le foglie degli alberi, il personal computer o lo smart phone con il quale stai guardando questa lezione e anche tu e io

siamo formati da atomi.

Sin dall’antichità gli esseri umani si interrogarono sulla natura dei corpi materiali e nell’antica Grecia furono avanzate due teorie filosofiche contrapposte.
La prima teoria fu la teoria atomistica proposta da Leucippo, Democrito ed Epicuro, e poi ripresa in epoca romana da Lucrezio. Essa prevedeva che la materia fosse composta da particelle microscopiche indivisibili (gli atomi, per l’appunto) in continuo movimento e caratterizzati da grandezze e forme differenti. I diversi tipi di atomi e le loro combinazioni davano luogo al mondo materiale.
Contrapposta alla teoria atomistica, Aristotele propose una teoria secondo la quale la materia aveva una composizione continua e non discreta e negando quindi anche l’esistenza in natura del vuoto. La varietà dei corpi era data dalla combinazione di quattro soli elementi: aria, acqua, terra, fuoco.
La teoria di Aristotele prevalse per molti secoli e solo nel 1600 cominciò a riaffacciarsi la teoria atomistica. Il primo passo furono gli esperimenti di Torricelli, che dimostrarono l’esistenza del vuoto. Successivamente, gli studi sul comportamento dei gas condotti da Newton e Bernoulli ipotizzarono un modello di gas costituito da particelle microscopiche in continuo movimento. In ambito chimico, nel 1700 furono effettuati numerosi studi sulla composizione delle sostanze (Lavoisier, Proust e Dalton) e proprio basandosi su queste evidenze sperimentali lo stesso Dalton fu in grado di proporre una teoria in grado di interpretare i risultati fin allora ottenuti: la teoria atomica.
2. La teoria atomica di Dalton
Nel 1803 John Dalton formulò la prima teoria atomica, i cui postulati sono:
- la materia è costituita da atomi piccolissimi, indivisibili e indistruttibili;
- gli atomi di uno stesso elemento sono identici e hanno la stessa massa;
- il numero di atomi di un elemento presenti in un composto è un numero intero;
- gli atomi di un elemento non si convertono in un altro elemento mediante reazioni chimiche;
- gli atomi non possono essere né creati né distrutti, ma si trasferiscono interi da un composto all’altro.
Questa teoria era in grado di:
- interpretare i risultati sperimentali riassunti nelle così dette leggi ponderali della chimica:
- la legge di conservazione delle masse (Lavoisier): nel corso di una reazione chimica la somma delle masse dei reagenti è uguale alla somma delle masse dei prodotti;
- la legge delle proporzioni definite (Proust): in ogni sostanza composta, il rapporto tra le masse delle sostanze elementari che lo costituiscono è definito e costante;
- la legge delle proporzioni multiple (Dalton): quando un elemento si combina con la stessa massa di un secondo elemento per formare composti diversi, le masse stanno tra loro in rapporti esprimibili mediante numeri interi e piccoli.
- definire su scala microscopica il concetto di sostanza semplice e di sostanza composta;
- rappresentare simbolicamente la composizione delle sostanze mediante le formule chimiche;
- fornire un primo strumento concettuale per la determinazione dei pesi atomici.
All’inizio dell’800 le conoscenze non contemplavano in alcun modo una “struttura interna” dell’atomo né, di conseguenza, una comprensione profonda della natura delle forze che causavano l’instaurarsi dei legami chimici e delle interazioni intermolecolari. Tuttavia, sulla base di questo modello fu possibile realizzare uno straordinario sviluppo delle conoscenze sulla composizione della materia.
3. Elementi, sostanze semplici e sostanze composte
All’inizio dell’800 il concetto di elemento (o più correttamente di sostanza semplice) e di composto (o sostanza composta) erano concetti “operativi”, che avevano significato nel “registro macroscopico” delle sostanze:
- sostanza semplice (o elemento): una sostanza che non poteva essere decomposta in sostanze più semplici mediante processi di trasformazione chimica;
- sostanza composta (o composto): una sostanza che poteva essere decomposta in sostanze più semplici mediante processi di trasformazione chimica.
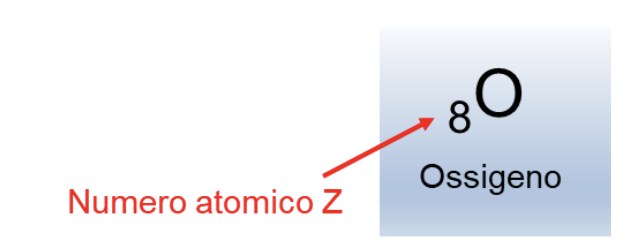
Come si vedrà nel seguito, ora intendiamo per elemento una specie atomica caratterizzata da: un ugual numero di numero di protoni nel nucleo atomico (ovvero dal suo numero atomico Z); un nome; un simbolo; una posizione definita nella tavola periodica.
Sulla base della teoria atomica possiamo quindi definire:
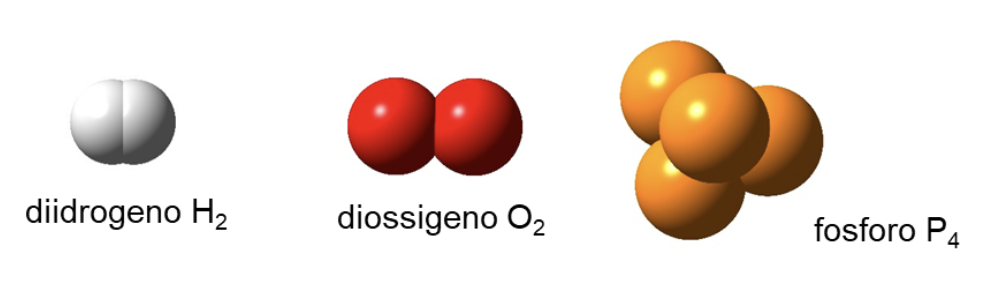
sostanza semplice: una sostanza costituita da atomi di un solo elemento
Alcuni elementi sono presenti in natura come sostanze semplici:
- come specie monoatomiche, ad esempio: l’Elio (He), il Neon (Ne) e gli altri gas nobili;
- come molecole biatomiche, ad esempio: H2, N2, O2, F2, Cl2, Br2, I2;
- come molecole poliatomiche, ad esempio P4, S8, Se8, C60 (noto come fullerene);
- alcuni sono invece presenti come solidi metallici (Fe, Cu) e altri come solidi reticolari covalenti (diamante, grafite, silicio).
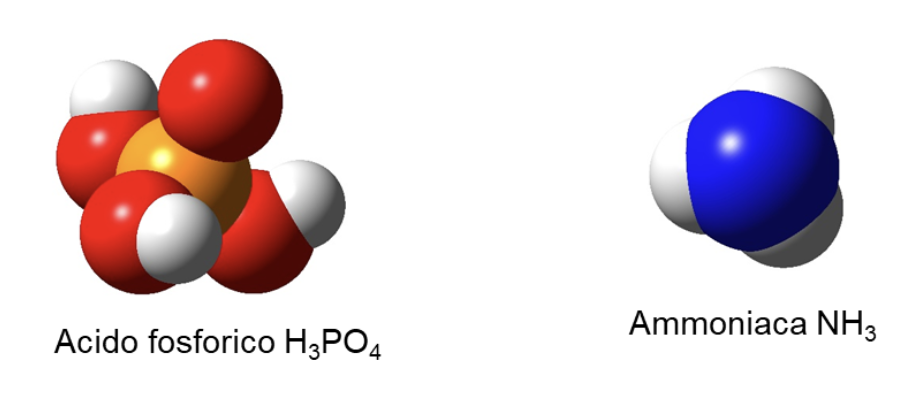
Sostanza composta: una sostanza costituita da atomi di elementi diversi.
Le sostanze composte costituiscono la stragrande maggioranza delle sostanze presenti sul nostro pianeta. Ad esempio, l’acido fosforico è formato dagli elementi fosforo, ossigeno e idrogeno; l’ammoniaca, dagli elementi azoto e idrogeno.
Sulla Terra la maggior parte degli elementi non si trova sotto forma di sostanze semplici ma si trova combinata chimicamente con altri elementi a formare sostanze composte. Ad esempio, il sodio si trova combinato con il cloro a formare il cloruro di sodio NaCl (sale da cucina), così come si ritrova in molti altri composti.
4. Masse atomiche relative
A partire dal modello atomico, Dalton potè attribuire un “peso atomico” agli atomi degli elementi. Poiché però non era possibile “pesare” un singolo atomo, definì dei pesi atomici relativi, oggi più propriamente definiti masse atomiche relative, indicate con il simbolo Ar.
Le masse atomiche relative sono definite come il rapporto fra:
ma(X): massa atomica di un atomo di un certo elemento X, espressa in grammi;
ma(H): massa atomica di un atomo di idrogeno, espressa in grammi, al quale venne attribuito arbitrariamente il valore unitario.
\( A_r(X)=\frac{\text{massa 1 atomo di X}}{\text{massa 1 atomo di H }}=\frac{m_{a}(X)g}{m_{a}(H)g} \)
La massa atomica relativa è quindi un numero che rappresenta quante volte la massa atomica dell’elemento è maggiore della massa atomica unitaria scelta come riferimento. Le masse atomiche relative Ar, essendo definite come rapporto fra masse, sono numeri adimensionali.
Per determinare la massa atomica relativa di un elemento, occorre conoscere per una certa sostanza:
- la composizione percentuale in massa degli elementi che costituiscono tale sostanza, determinata mediante la reazione di decomposizione nei suoi elementi costituenti;
- la sua formula chimica.
5. Masse atomiche assolute
Negli anni la convenzione di assumere pari a 1 la massa dell’atomo di idrogeno venne modificata, e fu scelto come riferimento la massa dell’isotopo 12 dell’atomo di carbonio (indicato come 12C), ovvero la massa di un atomo di C nel quale sono presenti 6 protoni e 6 neutroni.
Al 12C venne assegnata massa atomica relativa pari a 12 e l’unità di riferimento di massa atomica fu quindi quella pari a un dodicesimo della massa del 12C.
La nuova unità di misura di massa atomica venne indicata con il simbolo u o Da (in onore di Dalton).
\( 1u=\frac{m_a(^{12}C)g}{12} \)
\( A_r(X)= \frac{m_a(X)g}{\frac{m_a(^{12}C)g}{12}}= \frac{m_a(X)g}{1u} \)
La massa atomica relativa è quindi definita dal rapporto fra la massa atomica dell’atomo, espressa in grammi (o chilogrammi, nel sistema internazionale di unità di misura) e l’unità di massa atomica, pure espressa in grammi (o chilogrammi). Da cui:\( 1 u = \frac{1}{12}1,9926\ 10^{-23} g = 1,66\ 10^{-24} g \)
Pertanto la massa atomica di un atomo di H risulta pari a:
ma (\( g \)) = 1,008 \( u \) = 1,008 1,66 10-24 \( g \) = 1,67 10-24 \( g \)
6. Masse molecolari
Avendo a che fare con numeri molto piccoli, si comprende il vantaggio nell’avere definito una “unità di massa atomica” e di esprimere le masse atomiche in funzione di questa unità di misura.
Nella tabella sottostante, sono riportati per alcuni elementi i valori delle masse atomiche espressi in grammi (g) e in unità di massa atomica (u), insieme ai valori delle masse atomiche relative (adimensionate). I dati sono riportati con due cifre significative, fatta eccezione per l’idrogeno.
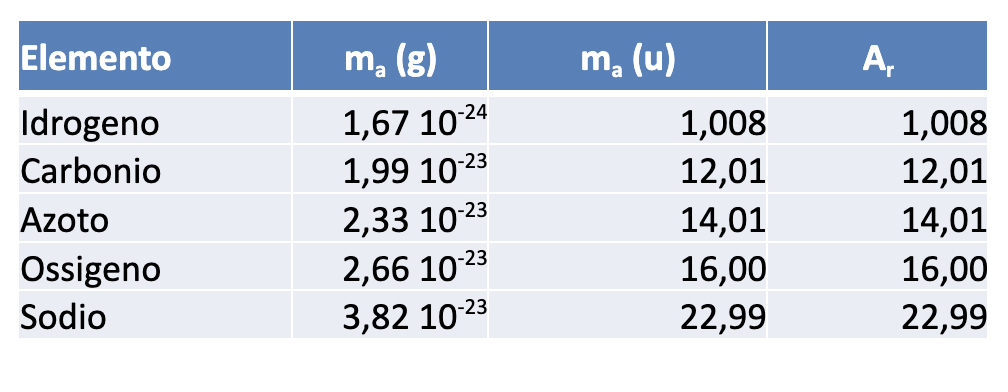
Una volta note le masse atomiche degli elementi, possiamo calcolare la massa di un composto definito da una data formula chimica. La massa molecolare relativa, \( M_r \), viene calcolata sommando le masse atomiche relative degli elementi presenti, ciascuna moltiplicato per il numero di atomi di quell’elemento presenti nel composto.
Ad esempio:
Sostanza: Acido solforico
Formula: H2SO4
\( Mr = 2 Ar(H) + Ar (S) + 4 Ar (O) = 2 1,008 + 32,07 + 4 16,00 = 98,09 \)
7. La tavola periodica degli elementi
Nell’800 le conoscenze del tempo non contemplavano in alcun modo una “struttura interna” dell’atomo né, di conseguenza, una comprensione profonda della natura delle forze che causavano l’instaurarsi dei legami chimici e delle interazioni intermolecolari. Tuttavia, il modello atomico di Dalton, insieme alle numerose evidenze sperimentali accumulatesi in quegli anni, permise nel 1869 al chimico russo Dmitrij Ivanovič Mendeleev di sistematizzare gli elementi chimici nella Tavola periodica degli elementi.
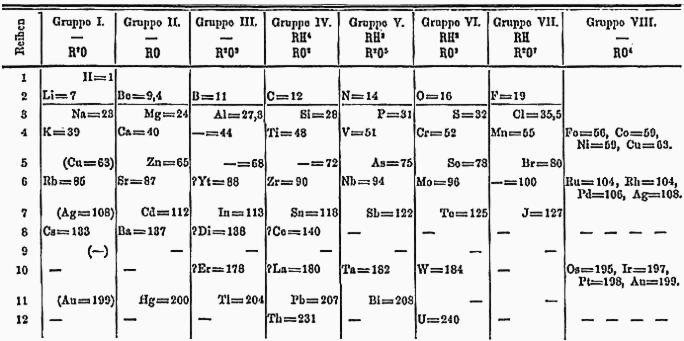
Nella Tavola gli elementi erano ordinati in base a:
- le masse atomiche relative (crescenti lungo le righe, chiamate periodi);
- le proprietà chimiche e fisiche (comuni lungo le colonne, chiamate gruppi).
8. La tavola periodica degli elementi moderna
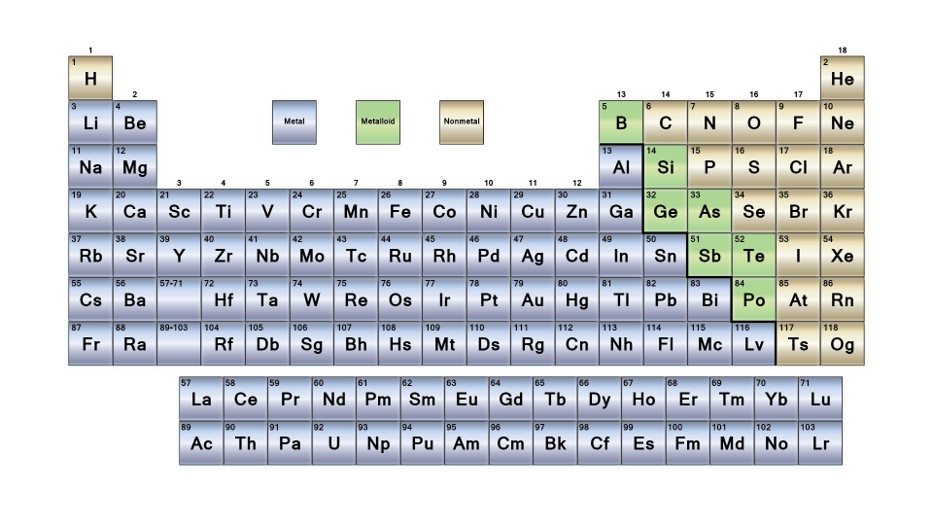
La Tavola periodica moderna è organizzata in:
- 7 periodi (righe)
- 18 gruppi (colonne).
Alcuni gruppi sono caratterizzati da un nome d’uso. Ad esempio, gli elementi del gruppo 1 vengono denominati metalli alcalini; quelli del gruppo 2, metalli alcalino terrosi; quelli del gruppo 17, alogeni; quelli del gruppo 18, gas nobili. I quattordici elementi che seguono il lantanio (lungo il settimo periodo) si chiamano lantanidi.
Gli elementi sono classificati in metalli e non-metalli; alcuni elementi presentano caratteristiche intermedie e sono classificati come semi-metalli:
- metalli: sono solidi (ad eccezione del mercurio), conducono l’elettricità e il calore, sono duttili, malleabili e possono formare leghe (soluzioni solidi) con altri metalli e i loro ossidi sono generalmente ossidi basici, ovvero in acqua formano soluzioni basiche;
- non metalli: possono essere solidi, liquidi o gassosi, non conducono corrente e i loro ossidi sono generalmente ossidi acidi, ovvero in acqua formano soluzioni acide;
- semi-metalli: presentano caratteristiche intermedie fra metalli e non metalli.
9. Le formule chimiche
La teoria atomica consente di esprimere in modo simbolico attraverso una formula chimica la composizione di una sostanza (entità macroscopica) in termini dei suoi costituenti microscopici (gli atomi).
Per ciascun elemento (indicato dal suo simbolo) presente nel composto, viene riportato il numero di atomi presenti: il numero è posto come pedice del simbolo dell’elemento.
Ad esempio:
sostanza: acido fosforico
formula: H3PO4
la molecola di acido fosforico è formata dagli elementi Idrogeno (H), Fosforo (P) e Ossigeno (O); ciascuna molecola di acido fosforico è costituita da 3 atomi di H (pedice di H = 3), 1 atomo di P (pedice sottinteso uguale a 1) e 4 atomi di O (pedice di O = 4). La sostanza acido fosforico è una sostanza composta.
Questo tipo di formula non indica però i legami fra gli atomi né la geometria della molecola. Per poter scrivere una formula di struttura, che contiene anche queste informazioni, occorrerà avere un modello atomico in grado descrivere i legami chimici.
In figura, sono riportate differenti rappresentazioni della formula di struttura dell’acido fosforico.
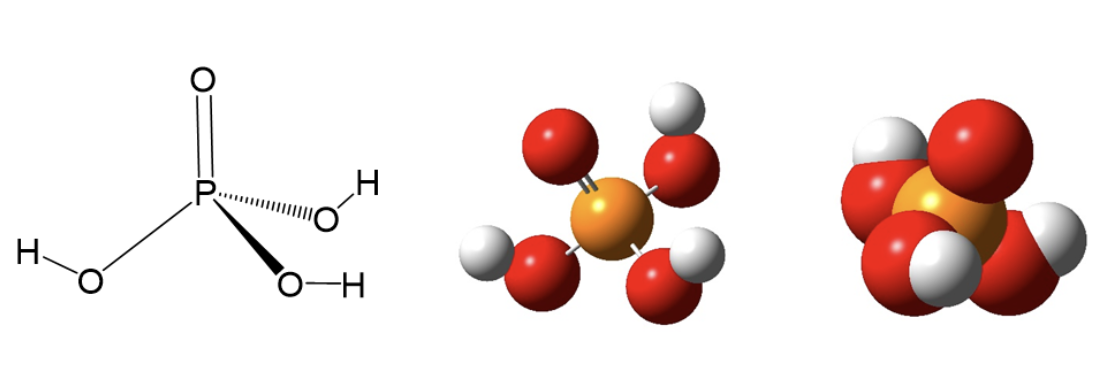
10. Formula minima
Ma come è possibile determinare la formula chimica di una sostanza?
È sufficiente conoscere:
- la composizione percentuale in massa degli elementi che costituiscono la sostanza;
- la massa atomica relativa degli elementi.
In questo modo è possibile determinare la formula minima (anche detta formula empirica), che specifica la composizione della sostanza mediante il più semplice rapporto intero positivo degli elementi presenti.
11. Molecole, ioni, formula minima e formula molecolare
Gli atomi interagendo fra loro possono formare differenti tipi di legami, dando luogo a differenti tipi di composti:
- composti molecolari
- composti solidi ionici
- composti solidi covalenti.
I composti molecolari, possono trovarsi allo stato solido, liquido o gassoso a seconda delle condizioni di temperatura e di pressione. Nei composti molecolari, a livello microscopico, è possibile identificare una unità costitutiva elementare, la molecola.
La molecola è un’entità elettricamente neutra (cioè priva di carica positiva o negativa) costituita da due o più atomi o dello stesso elemento (che identifica a livello macroscopico una sostanza semplice) o di elementi diversi (che identifica a livello macroscopico una sostanza composta). In una molecola gli atomi sono fra loro legati attraverso la formazione di legami di tipo covalente, dei quali si parlerà più avanti. Per i composti molecolari è possibile definire la formula molecolare che identifica la composizione della sostanza a livello molecolare. Ad esempio, la formaldeide è una sostanza di formula molecolare CH2O e la molecola della formaldeide ha la seguente formula di struttura:
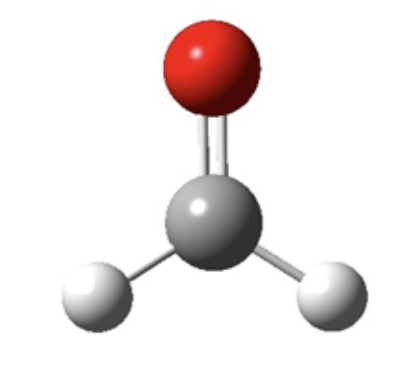
Non tutte le sostanze però sono formate da molecole. Nei composti ionici e nei composti solidi covalenti gli atomi non formano un'unità discreta (molecola singola), bensì sono legati tra loro secondo uno schema regolare, ordinato e ripetuto in un reticolo cristallino. In queste situazioni la formula minima rappresenta il più piccolo aggregato di ioni elettricamente neutro presenti nel composto ionico o di atomi presenti nel solido covalente.
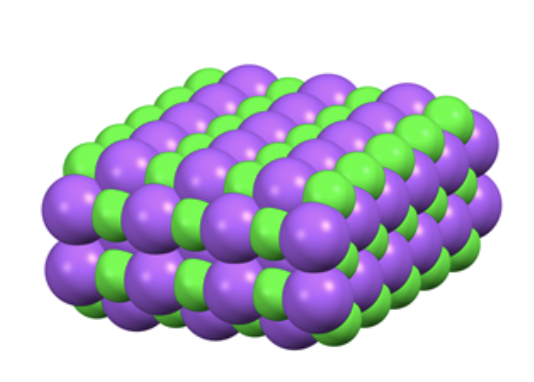
Composti solidi ionici: si presentano allo stato solido (a temperatura ambiente) e sono formati da ioni, cioè da atomi o gruppi di atomi che possiedono una carica elettrica positiva (cationi) o negativa (anioni) e formano un reticolo cristallino ordinato nel quale ioni positivi e negativi si alternano e sono legati da interazioni di tipo elettrostatico. Un esempio di composto solido ionico è il Cloruro di Sodio, ovvero il comune sale da cucina, la cui formula minima è NaCl, e la struttura cristallina del solido è riportata nella figura sottostante, dove in verde sono riportati gli ioni Sodio e in viola gli ioni Cloruro:
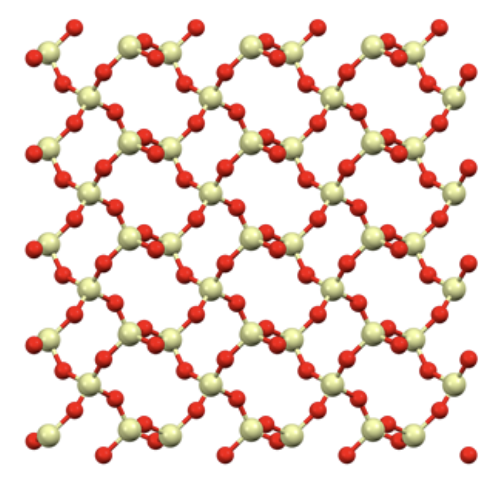
Composti solidi covalenti: sono solidi cristallini composti da atomi che formano legami chimici mediante legami di tipo covalente, ma nei quali non è possibile identificare l’entità “molecola”. Composti solidi covalenti contenenti solo atomi di Carbonio sono il diamante e la grafite; un composto solido covalente a base di Silicio e Ossigeno è il quarzo, la forma cristallina del biossido di silicio, la cui formula minima è SiO2, e la cui struttura cristallina è riportata nella figura sottostante, dove in rosso sono riportati gli atomi di Ossigenoe in giallo gli atomi di Silicio.
12. Formula molecolare
La formula minima non sempre è sufficiente a determinare univocamente un composto molecolare. Infatti, a parità di formula minima possono esistere molecole la cui formula molecolare è data da un multiplo intero della formula minima. Ad esempio: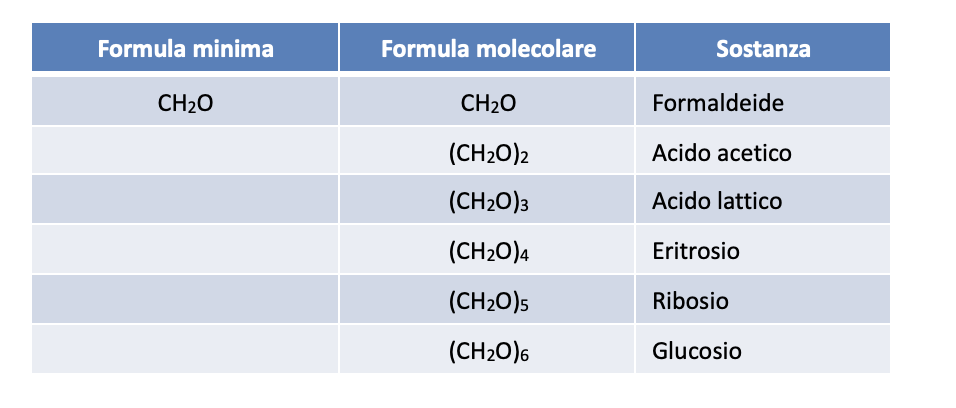
La composizione percentuale in massa degli elementi che costituiscono queste diverse sostanze è la stessa e non permette quindi di distinguerle. Per poterle distinguere occorre che sia stata determinata, mediante opportune tecniche sperimentali, la massa molecolare del composto in esame. In tal caso, si potrà ricavare il fattore moltiplicativo della formula minima che fornirà la formula molecolare.
Formula molecolare = p x Formula minima
ovvero:
\( p=\frac{M_r(formula\ molecolare)}{M_r (formula\ minima)} \)