Fissaidee 2
| Sito: | Federica Web Learning - LMS |
| Corso: | Scienze chimiche di base |
| Unit: | Fissaidee 2 |
| Stampato da: | Guest user |
| Data: | martedì, 26 agosto 2025, 21:25 |
Indice Unit
- 1. Dall’atomo di Dalton al modello atomico di Thomson
- 2. Il modello atomico di Rutherford
- 3. Il modello atomico di Bohr
- 4. Funzioni d’onda e numeri quantici /1
- 5. Funzioni d’onda e numeri quantici /2
- 6. La configurazione elettronica degli atomi
- 7. Numero atomico e tavola periodica degli elementi
- 8. Proprietà periodiche: la carica nucleare efficace e il raggio atomico
- 9. Proprietà periodiche: Energia di ionizzazione e Affinità elettronica
1. Dall’atomo di Dalton al modello atomico di Thomson
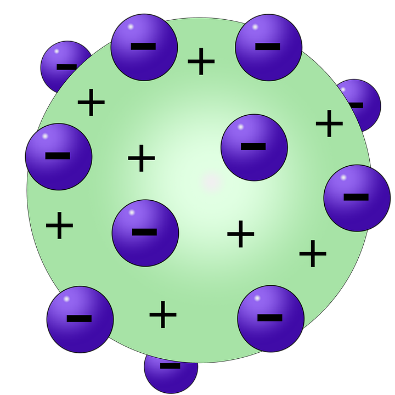
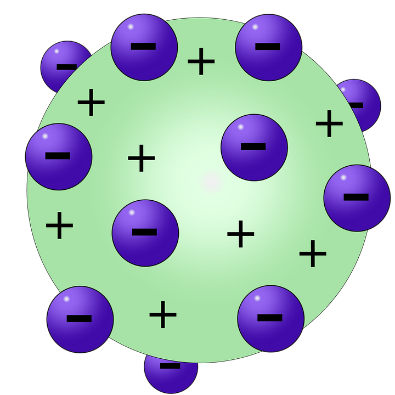
L’atomo di ThomsonLavoisier e Proust furono tra i primi a scoprire le leggi fondamentali che regolano la formazione dei composti nelle reazioni chimiche.
Per razionalizzare queste leggi l’inglese John Dalton propose la cosiddetta teoria atomica, secondo cui gli atomi sono particelle così piccole da essere invisibili anche al microscopio e ogni elemento chimico è costituito da atomi identici.
È importante sottolineare che in greco il termine atomo significa “indivisibile”, e di conseguenza nella teoria di Dalton gli atomi rappresentano i “mattoni base” di cui è formata la materia.
Tuttavia, alla fine dell’Ottocento i coniugi Pierre e Marie Curie scoprirono la radioattività, cioè quel fenomeno per cui gli atomi di alcuni elementi si trasformano spontaneamente in atomi di elementi più leggeri, emettendo in tale processo delle particelle elettricamente non neutre (particelle alfa o particelle beta).
Nello stesso periodo il fisico Joseph John Thomson, durante lo svolgimento di esperimenti con i tubi catodici aveva identificato delle particelle più piccole degli atomi caratterizzate da una carica negativa. A tali particelle è stato dato il nome di elettroni).
Sulla base di tali osservazioni Thomson propose il primo modello dell’atomo caratterizzato da una struttura interna: tale modello, a cui spesso ci si riferisce come modello dell’atomo a “panettone”, prevedeva un atomo composto da una distribuzione di carica positiva diffusa all'interno della quale sono inserite le cariche negative.
2. Il modello atomico di Rutherford
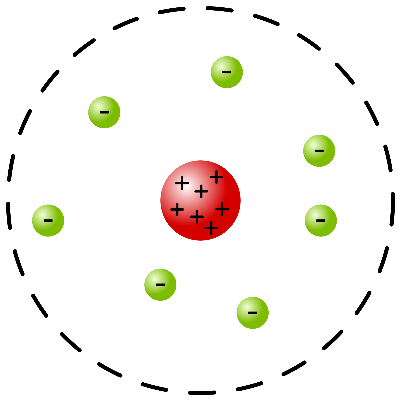
L’atomo di RutherfordNel 1911 il fisico neozelandese Ernest Rutherford eseguì una serie di esperimenti destinati a rivoluzionare i modelli utilizzati fino ad allora per descrivere gli atomi. Utilizzando una sorgente radioattiva, “bombardò” una sottile lamina d’oro con delle particelle alpha, cioè particelle che ora sappiamo essere formate da due protoni e due neutroni. Secondo il modello atomico di Thomson, queste particelle avrebbero dovuto subire una piccola deviazione nella loro traiettoria, a causa della repulsione tra le particelle alfa (cariche positivamente) e la carica positiva distribuita negli atomi dell’oro. Rutherford osservò invece che la maggior parte delle particelle alfa attraversava la lamina d’oro senza subire alcuna deviazione, mentre poche particelle rimbalzavano come se avessero colpito un oggetto impenetrabile.
Sulla base di tali osservazioni Rutherford propose un nuovo modello dell’atomo, secondo cui:
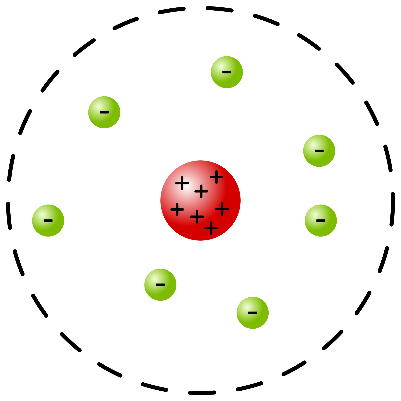
- la carica elettrica positiva dell’atomo è concentrata in un nucleo centrale estremamente piccolo (caratterizzato da un raggio di circa 10-14 m);
- gli elettroni orbitano intorno al nucleo, a una distanza che equivale; all’incirca a diecimila volte il raggio del nucleo. Di conseguenza, secondo questo modello dell’atomo gli elettroni orbitano intorno al nucleo in modo analogo a come i pianeti del sistema solare orbitano intorno al Sole.
Questo nuovo modello di atomo è in accordo con i risultati dell’esperimento di Rutherford in quanto:
- la maggior parte delle particelle alfa è caratterizzata da una traiettoria che passa nello spazio vuoto tra il nucleo e gli elettroni, e quindi attraversa gli atomi senza essere perturbata;
- alcune particelle però colpiscono il nucleo, e quindi rimbalzano.
3. Il modello atomico di Bohr
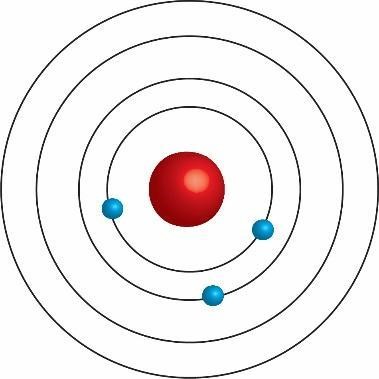
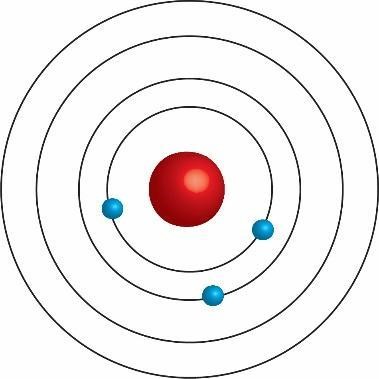
L’atomo di Bohr 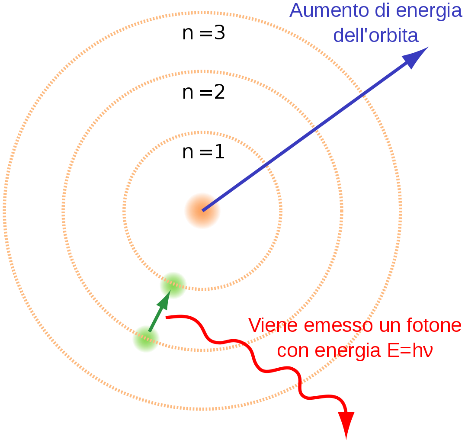
L’atomo di Bohr e la quantizzazione dell’energia - L’elettrone può percorrere solo determinate orbite circolari, senza emettere e cedere energia.
- Alle orbite permesse è associato uno specifico (quantizzato) valore di energia (che dipende dal raggio dell’orbita, quindi dalla distanza elettrone - nucleo)
- Per passare da un’orbita a un’altra orbita più distante dal nucleo, l’elettrone assorbe energia.
- Per passare da un’orbita a un’altra orbita più vicina al nucleo, l’elettrone emette energia sotto forma di radiazione elettromagnetica.
Nel modello dell’atomo di Rutherford è però presente un enorme problema concettuale: gli elettroni che orbitano intorno al nucleo si muovono di moto accelerato, poiché la loro direzione cambia continuamente. Secondo le leggi della fisica, una particella elettricamente carica che si muove di moto accelerato deve emettere energia e di conseguenza perdere energia. Di conseguenza gli elettroni dovrebbero cadere sul nucleo, e gli atomi risulterebbero instabili, in contraddizione con le osservazioni sperimentali.
Per risolvere questa apparente contraddizione, e tenere conto delle osservazioni sperimentali ottenute studiando gli spettri di assorbimento ed emissione degli atomi, nel 1913 il fisico danese Niels Bohr propose un nuovo modello atomico.
Secondo questo nuovo modello, gli elettroni dell’atomo possono muoversi soltanto su orbite caratterizzate da una specifica e ben precisa distanza dal nucleo.
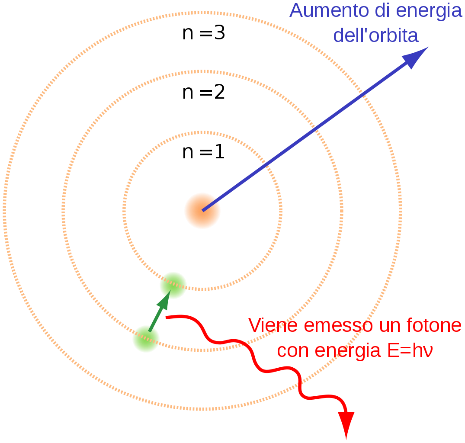
In altri termini, nel modello atomico proposto da Bohr il raggio e l’energia delle orbite degli elettroni sono grandezze quantizzate: cioè grandezze che non possono variare in modo continuo ma che possono assumere solo specifici valori discreti.
Purtroppo anche il modello di Bohr presenta dei limiti, in quanto non permette di descrivere adeguatamente le proprietà degli atomi che possiedono più di un elettrone.
4. Funzioni d’onda e numeri quantici /1
Nello stesso periodo in cui Bohr formulava il nuovo modello per descrivere gli atomi, nuove teorie ed osservazioni stavano rivoluzionando la fisica: per spiegare alcune peculiari proprietà della materia, il fisico De Broglie sviluppò una teoria secondo cui la materia poteva essere descritta sia come formata da particelle ma equivalentemente come onde interagenti tra di loro. Quasi contemporaneamente il fisico Heisenberg formulava il cosiddetto principio di indeterminazione, secondo cui non è possibile conoscere contemporaneamente ed esattamente la posizione e la velocità di una particella di massa molto ridotta, come un elettrone.
Queste nuove osservazioni e teorie, che costituiscono le basi su cui si è sviluppata la meccanica quantistica, portarono a dedurre che le informazioni sul moto degli elettroni negli atomi possono essere descritte adeguatamente solo in modo probabilistico. In altri termini, il concetto di orbita di un elettrone si rivela superato e inadeguato.
L’oggetto matematico che meglio si adatta per descrivere il comportamento degli elettroni, tenendo conto delle osservazioni di De Broglie e Heisenberg, è l’onda stazionaria. In particolare, le onde stazionarie che descrivono adeguatamente gli elettroni in un atomo si possono ricavare risolvendo una equazione proposta dal fisico Schrödinger nel 1926. Per ottenere soluzioni fisicamente accettabili, nell’equazione di Schrödinger devono comparire dei parametri che possono assumere solo determinati valori (e in questo modo dall’equazione otteniamo delle soluzioni – onde stazionarie – caratterizzate da una energia specifica, quindi quantizzata).
Tale funzione, se elevata al quadrato, fornisce inoltre informazioni sulla probabilità di trovare l’elettrone in un punto particolare dello spazio intorno al nucleo.
5. Funzioni d’onda e numeri quantici /2
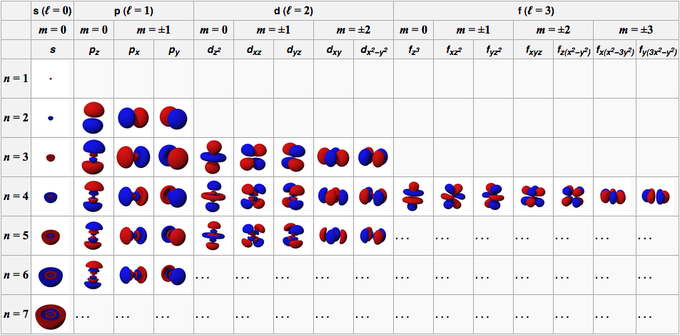
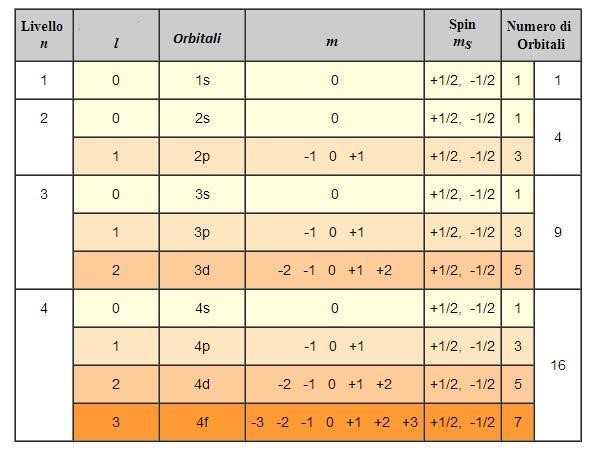
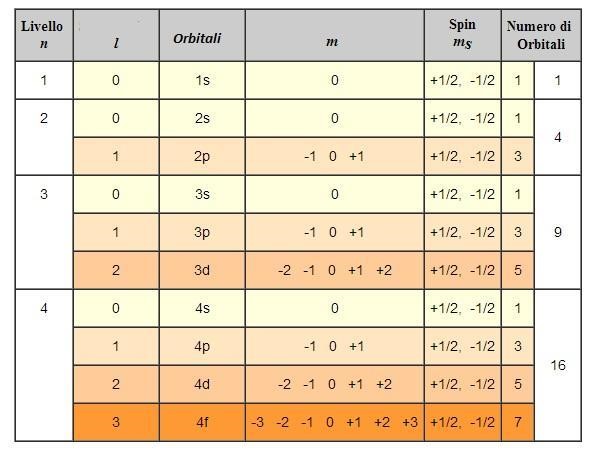
I parametri che devono essere inseriti nell’equazione per risolverla vengono detti numeri quantici (e si indicano con le lettere n, l e m e ms).
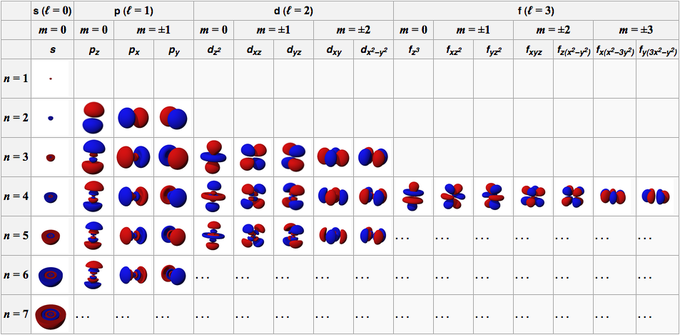
Definiamo l’orbitale come la funzione d’onda dell’elettrone che si ottiene risolvendo l’equazione di Schrödinger utilizzando una particolare quaterna di valori di n, l, m e ms.
- Numero quantico principale n
(n) = 1, 2, 3…,7; cioè numeri interi partendo da 1): definisce il livello energetico dell’elettrone, e definisce la “dimensione” dell’orbitale.
- Numero quantico secondario l
(l = 0, 1,…, n-1; cioè tutti valori interi da 0 a n-1): determina le caratteristiche geometriche (la forma) dell’orbitale.
- Numero quantico magnetico m
(m = -l, 0, +l; cioè tutti i valori interi da -l a +l, zero compreso): definisce l’orientazione degli orbitali.
- Numero quantico di spin ms
(ms = ± 1/2.): indica il valore di spin che può essere associato all’elettrone. Lo spin è una proprietà dell’elettrone che si manifesta quando questo è sottoposto all’azione di un campo magnetico.
Gli elettroni di un atomo non possono essere caratterizzati dai quattro numeri quantici identici, in quanto questo significherebbe avere elettroni con le stesse caratteristiche (e quindi anche elettroni che occupano le stesse regioni intorno al nucleo, con conseguente elevatissima repulsione tra gli stessi). Questo principio viene detto principio di esclusione di Pauli.
6. La configurazione elettronica degli atomi
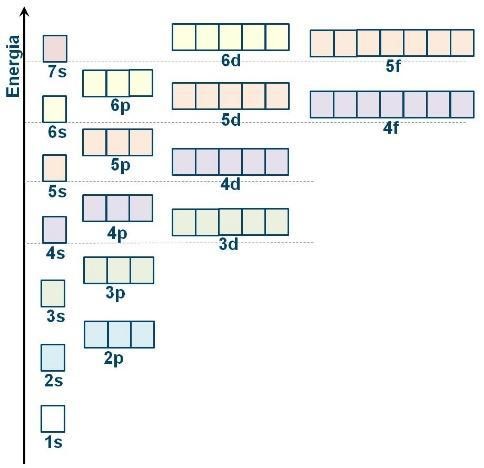
La configurazione elettronica degli atomiL’insieme delle funzioni d’onda, ovvero degli orbitali, che descrivono gli elettroni di un atomo è chiamata configurazione elettronica.
Lo stato di più bassa energia di un atomo (stato fondamentale) è quello nel quale gli elettroni sono descritti dagli orbitali di più bassa energia. Ne consegue la regola di Aufbau, secondo la quale la configurazione elettronica fondamentale si costruisce assegnando gli elettroni agli orbitali a partire da quelli di più bassa energia.
Nota: Anche se ad essere rigorosi la terminologia è errata, comunemente ci si riferisce agli elettroni di un atomo come elettroni che “occupano” gli orbitali dell’atomo stesso. In realtà, l’orbitale non è occupato da un elettrone, ma l’orbitale (cioè la funzione d’onda) è l’elettrone, nell’ambito del formalismo che utilizziamo per descrivere gli atomi.
In un atomo non possono coesistere elettroni caratterizzati dai quattro numeri quantici identici. Ne consegue che in uno stesso orbitale (caratterizzato da una terna di numeri quantici) possono essere presenti al massimo due elettroni, che devono avere numero quantico ms (il quarto numero quantico), ovvero spin, differente. Inoltre, secondo quella che è conosciuta come la regola di Hund, se sono presenti orbitali iso-energetici, nel descrivere la configurazione elettronica dell’atomo in esame, prima si colloca un elettrone su ciascun orbitale vuoto, e poi si completano gli orbitali semipieni. Nella configurazione elettronica più stabile di un atomo, gli elettroni che occupano singolarmente orbitali iso-energetici tendono ad assumere lo stesso spin.
7. Numero atomico e tavola periodica degli elementi
L’identità chimica di un elemento è determinata dal numero dei suoi protoni, ovvero dal numero dei suoi elettroni quando l’atomo è elettricamente neutro. Questo numero viene definito numero atomico e si indica con la lettera Z.
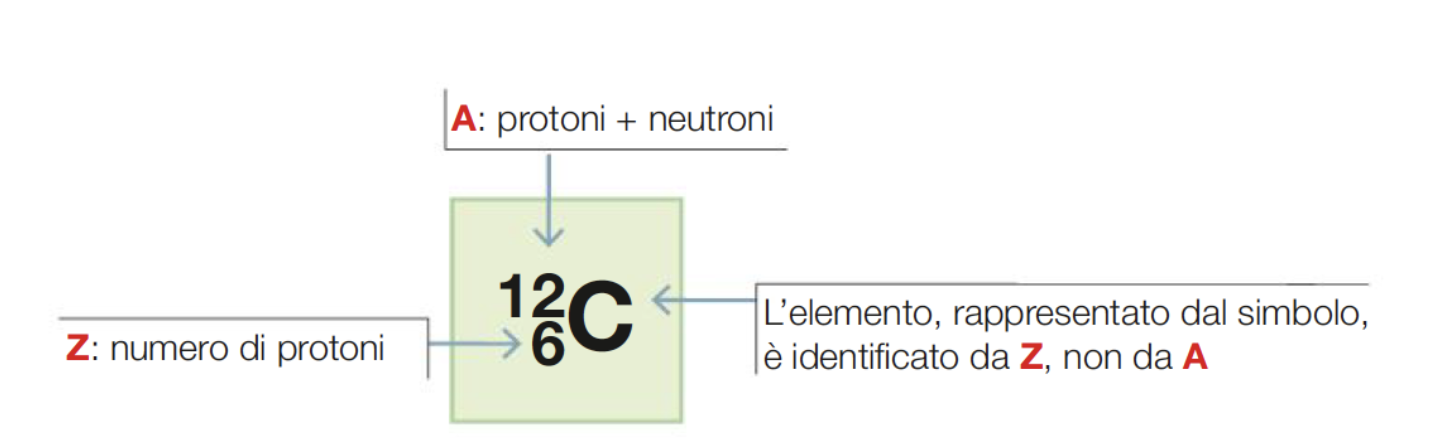
Numero atomico e numero di massa
Il numero di massa (A) viene definito come la somma di neutroni e protoni presenti nel nucleo
Alla luce di queste definizioni, la Tavola Periodica degli elementi è strutturata nel seguente modo:
- Muovendosi da sinistra verso destra, e dall’alto verso il basso, il numero atomico degli elementi aumenta;
- le righe orizzontali vengono dette periodi. Il numero progressivo dei periodi corrisponde al numero quantico principale n;
- le colonne vengono dette gruppi: gli atomi di ciascun gruppo presentano lo stesso numero di elettroni di valenza.
Riassumendo, un elemento è definito in modo univoco dal numero di protoni presenti nel nucleo (che non varia nel corso delle reazioni chimiche, mentre può variare il numero di elettroni); da un nome e da un simbolo; dalla sua posizione nella tavola periodica.
Atomi di uno stesso elemento che presentano un numero differente di neutroni (ovvero presentano differente numero di massa, definito dalla somma del numero di protoni e neutroni presenti nel nucleo) vengono definiti isotopi. Gli isotopi di un elemento presentano proprietà fisiche differenti ma proprietà chimiche identiche.
8. Proprietà periodiche: la carica nucleare efficace e il raggio atomico
L’osservazione sperimentale evidenzia come la dimensione degli atomi, che noi quantifichiamo con la grandezza “raggio atomico”, varia in modo regolare nella tavola periodica. In particolare, gli atomi diventano via via più piccoli muovendosi da sinistra a destra nei periodi, e diventano via via più grandi scendendo dall’alto verso il basso nei gruppi. Per razionalizzare in modo semplice ed efficace i motivi alla base di tale regolarità si deve ricorrere al concetto di carica nucleare efficace, cioè la carica nucleare di cui effettivamente risentono gli elettroni di valenza, che essendo quelli più esterni nell’atomo ne definiscono di conseguenza anche le dimensioni.
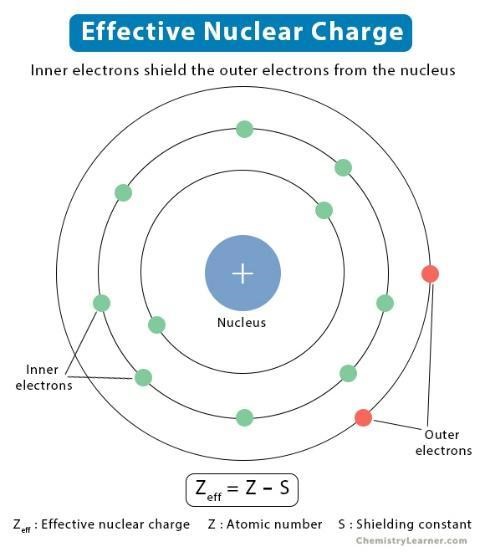
Definizione di carica nucleare efficace
La carica nucleare efficace si può calcolare in modo molto semplice (anche se approssimato) secondo la seguente relazione.

Il calcolo della carica nucleare efficaceCNE = Numero atomico (quindi carica del nucleo) – Elettroni di core (quindi tutti gli elettroni caratterizzati da numero quantico principale minore del numero quantico principale che caratterizza gli elettroni di valenza).
Questa semplice operazione matematica permette di valutare in modo semplificato quale è l’effetto di “schermo” esercitato dagli elettroni di core sulla carica del nucleo. In altri termini, permette di valutare in modo semplificato quale è la carica nucleare non schermata di cui risentono gli elettroni di valenza. Ovviamente, maggiore la CNE e maggiore sarà l’attrazione esercitata dal nucleo sugli elettroni di valenza; e quindi, minore il raggio atomico.
Definizione di raggio atomico
Proprietà periodiche: Il raggio atomico
9. Proprietà periodiche: Energia di ionizzazione e Affinità elettronica
Una delle proprietà atomiche più rilevanti per razionalizzare il comportamento chimico degli atomi è l’energia di ionizzazione, che viene definita come l’energia che bisogna fornire a un atomo per allontanare uno dei suoi elettroni di valenza (che essendo quelli più esterni, sono quelli che meno risentono dell’attrazione nucleare). L’energia di ionizzazione generalmente aumenta lungo il periodo e diminuisce lungo il gruppo.
Questo andamento è spiegabile considerando che lungo i periodi la carica nucleare efficace aumenta (muovendosi da sinistra a destra), mentre lungo i gruppi la CNE (come definita nelle slide precedenti) rimane costante, ma gli elettroni di valenza sono sempre più lontani dal nucleo via via che si scende lungo il gruppo (dato che il numero di elettroni di core aumenta scendendo nel gruppo).
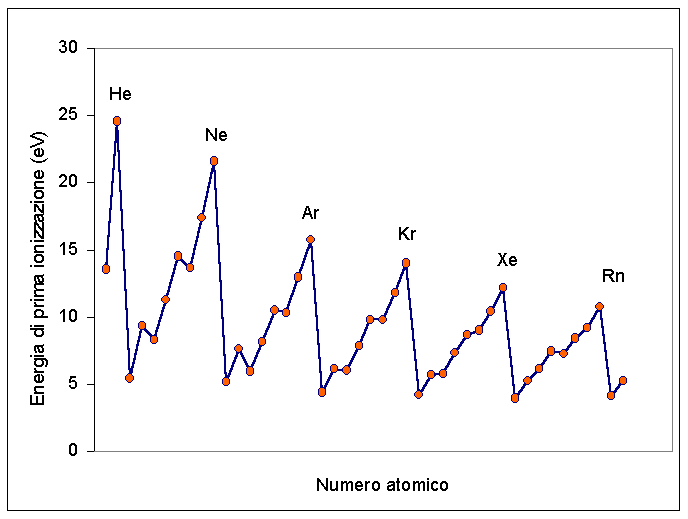
Andamento periodico di Energia di Ionizzazione
Un’altra proprietà atomica rilevante, e in qualche modo complementare all’energia di ionizzazione, è l’affinità elettronica, che viene definita come l’energia che viene liberata per aggiungere un elettrone ad un atomo neutro. L’affinità elettronica diventa generalmente più grande muovendosi lungo un periodo (quindi più energia viene liberata man mano che ci sposta da sinistra a destra lungo il periodo) e più piccola scendendo lungo il gruppo. Analogamente a quanto discusso per l’energia di ionizzazione, anche questo andamento si può semplicemente spiegare tenendo conto di come varia la carica nucleare efficace nella tavola periodica. È importante notare che i gas nobili, che hanno gli orbitali di valenza completamente occupati, sono caratterizzati da una affinità elettronica positiva. Questo perché, nel caso di un gas nobile, il valore di CNE di cui risentirebbe l’elettrone che viene aggiunto all’atomo è zero!