Fissaidee 3
| Site: | Federica Web Learning - LMS |
| Course: | Scienze chimiche di base |
| Unit: | Fissaidee 3 |
| Printed by: | Utente ospite |
| Date: | Tuesday, 26 August 2025, 7:01 PM |
Table of contents
- 1. Le forze in gioco nella formazione di un legame chimico
- 2. L’andamento dell’elettronegatività nella tavola periodica
- 3. Il legame ionico porta a reticoli estesi, il legame covalente genera molecole
- 4. Il diverso rapporto tra raggi ionici impone reticoli ionici diversi
- 5. Come si riconosce un composto ionico
- 6. Metalli, non metalli e semimetalli. Ossidi basici e ossidi acidi
- 7. Le formule di Lewis e la regola dell'ottetto
- 8. Istruzioni per le formule di Lewis
- 9. Le formule di risonanza
- 10. Il legame metallico
- 11. Le geometrie ideali e le geometrie effettive secondo la VSEPR
- 12. Le varie geometrie molecolari
- 13. La polarità molecolare
- 14. Le diverse tipologie di forze intermolecolari
- 15. Il legame idrogeno
1. Le forze in gioco nella formazione di un legame chimico
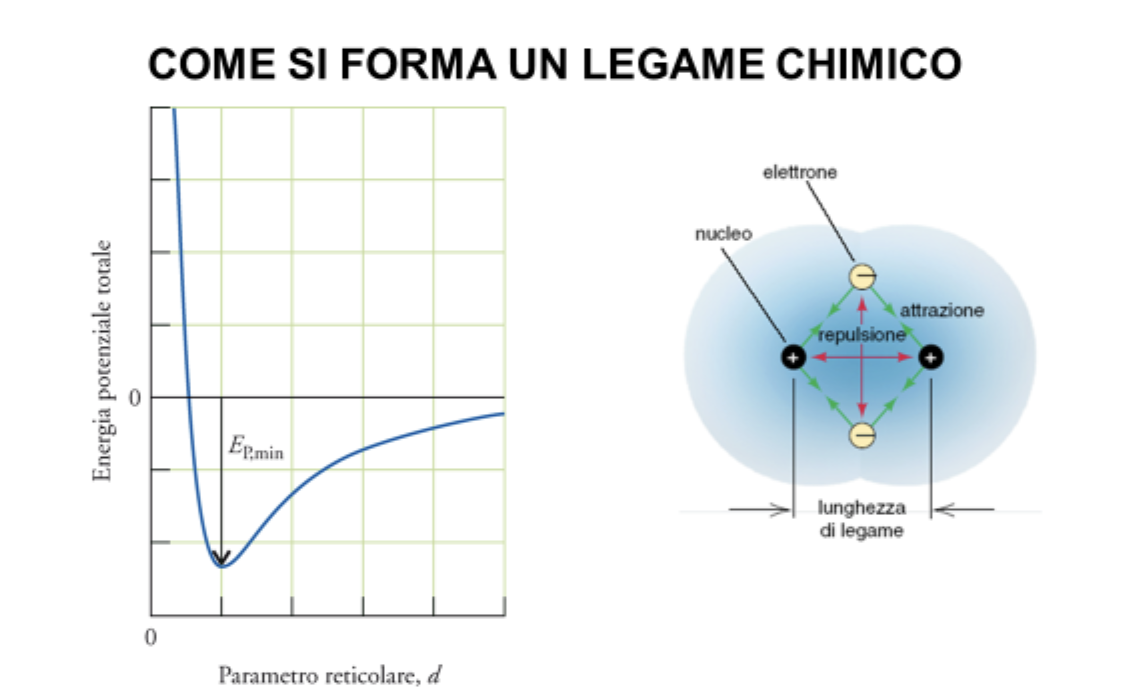
Quindi possono generarsi forze elettrostatiche (coulombiane) tra atomi diversi.
A lunga distanza (atomi lontani) prevalgono le attrazioni. Quindi gli atomi si avvicinano e l’energia potenziale complessiva diminuisce.
A corta distanza (atomi vicini) prevalgono le repulsioni e occorrono quantità di energia crescenti per avvicinare ulteriormente i due atomi.
Esiste quindi una distanza ottimale in cui attrazioni e repulsioni si equivalgono, e in questa condizione i due atomi sono in un minimo di energia, e rimarranno vincolati in una situazione che possiamo definire di legame chimico.
La causa dei legami chimici è semplice, e l’unica forza in gioco è quindi l’energia elettrostatica. Ma la condizione di equilibrio di tutte queste forze simultanee non è sempre la stessa, e quindi è opportuno suddividere i legami in base al risultato finale.
2. L’andamento dell’elettronegatività nella tavola periodica
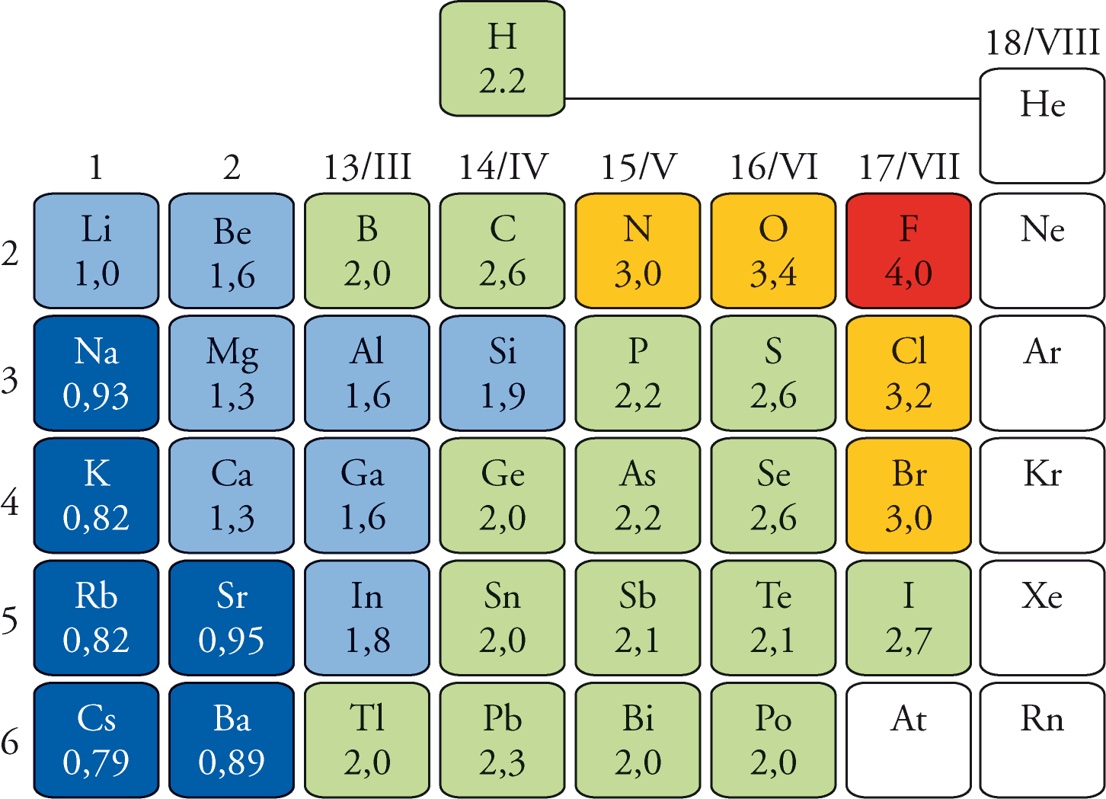
La forza d’attrazione esercitata da un atomo sugli elettroni degli atomi a distanza di legame viene definita elettronegatività.
Essa ovviamente dipende dalla carica del nucleo che non viene schermata dagli elettroni atomici (=Carica Nucleare Efficace). Ma, a differenza delle altre proprietà periodiche (energia di ionizzazione ed affinità elettronica) dipende dalle reciproche interazioni di tutti gli atomi che si combinano, e quindi non è una proprietà intrinseca del singolo atomo. Dunque, essa può essere calcolata tramite diversi modelli teorici, e non deve stupire se diversi scienziati hanno proposto criteri diversi per definire lo stesso concetto. E non deve stupire se i valori nelle diverse scale non sono né uguali, né nello stesso ordine.
La scala di elettronegatività più usata è quella dovuta a Pauling, che ha “inventato” il concetto: ma la definizione più efficace, e che meglio chiarisce il concetto, è stata introdotta da Mulliken nel 1934. Secondo quest’ultimo, l’elettronegatività è proporzionale alla media tra affinità elettronica e energia di ionizzazione [EN ∝ (EI - AE)/2]. Infatti queste due grandezze misurano, da una parte, la tendenza di un atomo a catturare elettroni, e, dall’altra, la sua resistenza a perderne. È quindi del tutto ovvio che l’elettronegatività segue fedelmente l’andamento di queste due proprietà periodiche (molto elevata nell’angolo in alto a destra della tavola periodica, molto bassa nell’angolo in basso a sinistra). In particolare, i “top five” nella classifica dell’elettronegatività sono F, O, N, Cl, Br e gli “ultimi in classifica” gli elementi più pesanti dei gruppi 1° e 2° (Sr, Ba, Rb, Cs).
Quindi l’elettronegatività è un parametro numerico molto efficace per prevedere il comportamento chimico degli elementi. Elementi con elettronegatività alta (colori rosso e giallo in figura) tenderanno, nei loro composti, ad accumulare elettroni. All’opposto, elementi con elettronegatività bassa (colore blu e azzurro nella figura), non saranno in grado di trattenere i propri elettroni (nessun atomo tende a perdere i propri elettroni), quindi saranno caricati positivamente.
In generale se i due atomi che interagiscono hanno elettronegatività molto diversa, uno esercita una forza d’attrazione molto superiore all’altro, e si ha uno spostamento notevole della nuvola elettronica. In questo caso, si parla di legame ionico.
Invece, quando i due atomi che interagiscono sono molto simili (o addirittura identici) la nuvola elettronica rimane confinata tra i due nuclei. In questo caso, si parla di legame covalente.
3. Il legame ionico porta a reticoli estesi, il legame covalente genera molecole
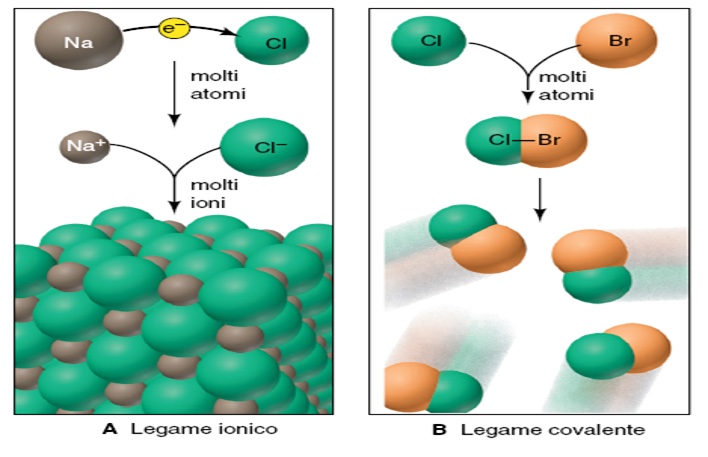
LEGAME IONICO
Se un solo atomo poco elettronegativo (uno dei primi gruppi della tavola periodica) reagisce con un solo atomo di un elemento molto elettronegativo (una situazione molto poco realistica) si ha una notevole ridistribuzione di carica tra gli atomi coinvolti, e si forma un aggregato biatomico con due estremità a cariche opposte (una coppia ionica). Le due estremità sono dette ioni (ione negativo= anione, ione positivo= catione).
Ma se il numero di atomi reagenti aumenta, (una situazione molto più verosimile) avviene un fenomeno molto diverso, e ogni atomo si circonda di molti altri ioni, formando aggregati molto più grossi. Si formano cioè reticoli ordinati tridimensionali detti cristalli ionici. La disposizione degli ioni in questi cristalli non è per nulla casuale, e deve massimizzare le attrazioni tra ioni di carica opposta (e quindi massimizzare le interazioni anione-catione) ma deve minimizzare le repulsioni tra ioni di carica uguale e quindi massimizzare la distanza tra gli anioni (e tra i cationi). In pratica ogni catione sarà circondato da molti anioni (e viceversa), evitando che questi stiano troppo vicini tra loro.
4. Il diverso rapporto tra raggi ionici impone reticoli ionici diversi
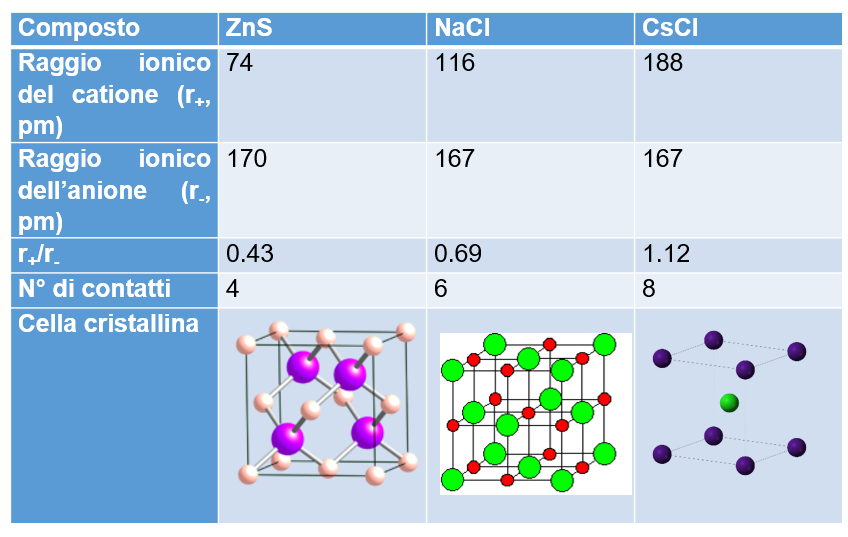
La disposizione degli atomi in tre reticoli ionici diversi, ZnS, NaCl e CsCl esemplifica molto bene il compromesso tra queste due necessità. Nella tabella sono riportati i raggi di anione e catione. È evidente che, al variare del rapporto tra i raggi, varia il numero di “contatti” tra anione e catione. In questi composti, ogni ione interagisce con un elevato numero di ioni di segno opposto e quindi non si può parlare di molecole individuali. Per questi composti la formula indica semplicemente la formula minima, cioè il rapporto in cui sono combinati anioni e cationi. Tale rapporto deve rispettare il principio di elettroneutralità (cariche positive e negative devono essere uguali).
La quantità di energia coinvolta nella formazione di un reticolo cristallino tridimensionale ordinato è molto maggiore di quella liberata da una singola coppia ionica, e questa può essere considerato il fattore energetico più rilevante nella formazione di un composto ionico.
5. Come si riconosce un composto ionico

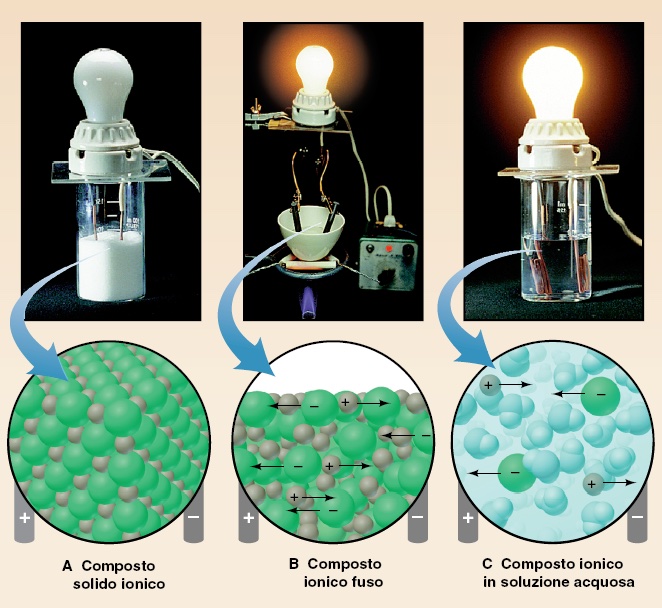
Quindi le caratteristiche che contraddistinguono un composto ionico sono:
- Cristalli ben formati, con facce, spigoli, vertici netti (spesso la forma richiama la disposizione degli atomi a livello microscopico);
- Alti punti di fusione (sono necessarie altissime temperature per vincere le attrazioni elettrostatiche tra gli ioni e permettere agli ioni di spostarsi dalle posizioni reticolari);
- Conducibilità allo stato fuso (una volta liberi di muoversi, gli ioni possono muoversi e trasportare carica);
- Conducibilità in soluzione (gli ioni persistono anche in soluzione, anche se circondati dalle molecole di solvente);
- Duri ma fragili (occorre uno stress intenso per staccare gli atomi, ma una volta formata la frattura, questa si propaga a tutto il cristallo e non c’è modo di ricomporre le due facce).
6. Metalli, non metalli e semimetalli. Ossidi basici e ossidi acidi
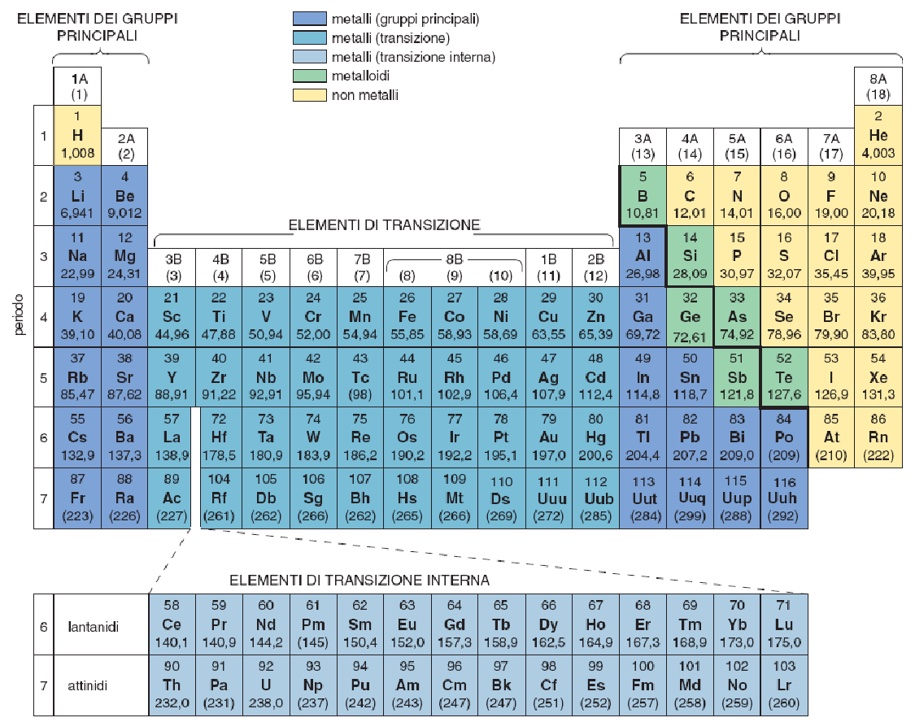
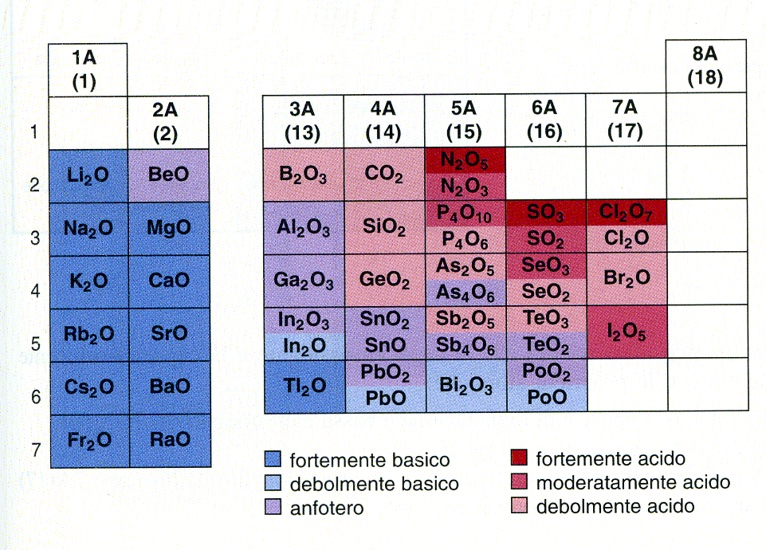
Nei composti ionici sono quindi presenti anioni (con carica negativa) e cationi (con carica positiva) Gli elementi con bassa elettronegatività che, in tali composti, si presentano sotto forma di cationi sono detti metalli e, all’opposto, quelli che assumono la forma anionica sono i non metalli. Si noti che questa definizione di metallo si basa soprattutto sul comportamento chimico, e non sulle proprietà fisiche solitamente associate ai metalli (alta conducibilità del calore ed elettrica). Quindi rientrano a pieno titolo nella categoria dei metalli elementi come sodio, potassio, calcio e magnesio. Infatti, i metalli occupano quasi i 4/5 delle caselle della tabella periodica. L’elettronegatività varia in maniera continua e graduale tra elementi vicini. Quindi, anche il confine tra metalli e non metalli non è netto, e man mano che ci si sposta verso destra (e verso l’alto) nella tabella periodica, le caratteristiche metalliche si affievoliscono. Esiste quindi un gruppo di elementi in cui le caratteristiche sono intermedie e tali elementi sono detti semimetalli. La suddivisione tra metalli e non metalli aiuta a capire la differenza di comportamento degli ossidi: i primi danno ossidi con forti caratteristiche ioniche (nella maggior parte dei casi con altissimi punti di fusione) e, se reagiscono con acqua, formano soluzioni basiche. Gli ossidi dei non metalli, invece, hanno carattere molecolare e covalente. Se reagiscono con acqua, formano soluzioni acide. Gli ossidi dei non metalli spesso sono gassosi a temperatura ambiente. Per questo si accumulano in atmosfera, causando spesso problemi di inquinamento (CO, SO2, NO2 etc.).
7. Le formule di Lewis e la regola dell'ottetto
LEGAME COVALENTE
Se gli atomi che si legano hanno elettronegatività confrontabili si forma un aggregato (la molecola) che esercita una forza d’attrazione trascurabile verso ogni altro atomo per cui rimane come unità a sé stante.
Il legame covalente è quindi tipico delle molecole organiche, composte principalmente da due elementi (carbonio e idrogeno) che hanno elettronegatività molto simile.
Uno strumento molto efficace per descrivere la distribuzione degli elettroni di valenza (quelli che occupano lo strato più esterno) nelle molecole è la formula di Lewis: uno schema grafico che riesce a prevedere molte caratteristiche molecolari, e permette in molti casi di spiegare la reattività.
Le formule di Lewis sono quindi degli schemi, in cui gli atomi sono rappresentati dai loro simboli chimici, e gli elettroni di valenza sono rappresentati da dei puntini. Al giorno d’oggi, si preferisce rappresentare le coppie di elettroni con dei trattini invece che con due puntini (- meglio di :).
FORMULE DI LEWIS E REGOLA DELL’OTTETTO
Le formule di Lewis sono state ideate quando ancora non erano chiare le complesse leggi della quantomeccanica, e si basavano su una semplice osservazione empirica, detta regola dell’ottetto: sono stabili i composti in cui gli atomi riempiono tutti e quattro gli orbitali dello strato di valenza, tramite trasferimento o condivisione di elettroni. Quindi, per scrivere le formule di Lewis non bisogna avere approfondite conoscenze chimiche, ma basta seguire alcune semplici regole operative.
8. Istruzioni per le formule di Lewis
LE ISTRUZIONI PER DISEGNARE UNA FORMULA DI LEWIS
- Stabilire il numero di elettroni di valenza (sommare gli elettroni di valenza di tutti gli atomi coinvolti ± l’eventuale carica)
- Mettere l’atomo meno elettronegativo al centro
- Mettere gli atomi più elettronegativi intorno
- Disegnare legami covalenti tra gli atomi
- Assegnare ad ogni atomo periferico tante coppie di elettroni quante ne servono per raggiungere l’ottetto
- Gli elettroni che avanzano vengono aggiunti all’atomo centrale
- SE l’atomo centrale non raggiunge l’ottetto, togliere una coppia di elettroni da un atomo periferico e usarla per un legame aggiuntivo.
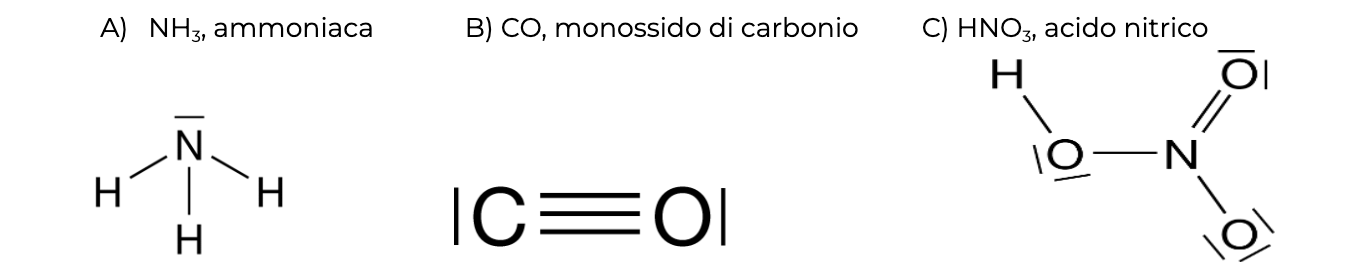
Dagli esempi su riportati si può vedere che le coppie di elettroni (le sbarrette) possono avere vari ruoli. Possono essere localizzate su un unico atomo (coppie di non legame), possono essere condivise tra due atomi (legame singolo) o possono esserci più coppie condivise tra gli stessi due atomi (legame multiplo, doppio o triplo). Al giorno d’oggi sappiamo che ciascuna coppia occupa un orbitale.
È chiaro che questi schemi semplificati non possono rappresentare rigorosamente la situazione effettiva, ma possono permettere di intuire la disposizione tridimensionale degli atomi (la geometria molecolare), l’accumulo di carica sugli atomi (la polarità molecolare), la forza dei legami. In molti casi, servono anche a spiegare come avvengono le reazioni chimiche.
9. Le formule di risonanza
Può capitare che ci siano più formule di Lewis che rispettano tutte le regole enunciate. In questi casi si parla di formule di risonanza. Esse vanno interpretate come formule estremamente semplificate della situazione reale, e tutte insieme contribuiscono a descrivere la complessità molecolare. In alcuni casi, le diverse formule sono simili, ma con orientazioni diverse. Per esempio, l’ozono (O3) può essere rappresentato con due formule di risonanza “degeneri” (di uguale energia, e quindi di uguale importanza).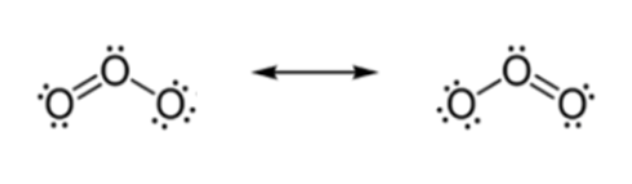
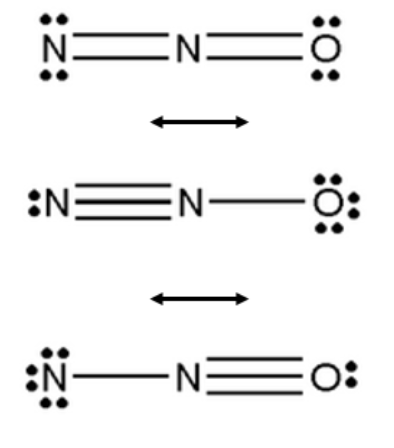
L’ambiguità delle formule di risonanza è proprio il limite principale delle formule di Lewis. Ma, in un certo senso, può anche essere considerato un pregio, perché l’insieme di questi schemi semplificati permette di interpretare fenomeni che altrimenti richiederebbero difficili strumenti matematici.
Bisogna ribadire che gli elettroni non sono puntini (disegnati sul foglio) che vanno collocati in un punto preciso. Al contrario, sono funzioni d’onda che possono essere “spalmate” su zone estese della molecola (il termine corretto è delocalizzazione).
Legame ionico e legame covalente sono due situazioni estreme (legame ionico = separazione di carica, legame covalente = condivisione di elettroni). Si possono avere anche tutte le situazioni intermedie, per cui è opportuno parlare di legami polari, in cui le due componenti contribuiscono entrambe alla formazione del legame (c’è sia un alto grado di condivisione, sia una rilevante separazione di carica). In questo caso si può parlare di percentuale di ionicità, e descrivere il legame con due formule di risonanza (ionica e covalente) di peso diverso.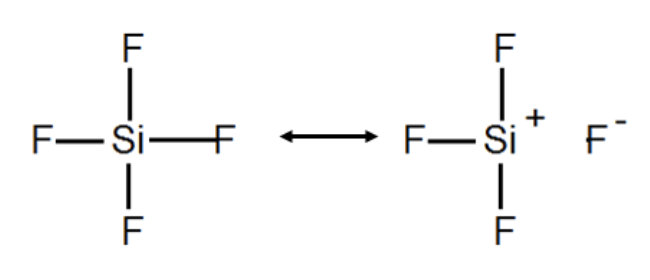
10. Il legame metallico
La delocalizzazione degli elettroni di legame è massima nel caso del legame metallico. Infatti gli elementi metallici allo stato solido formano dei reticoli cristallini molto densi, in cui ogni atomo viene circondato da un gran numero di atomi uguali (normalmente 8 o 12). Ma i metalli hanno pochi elettroni di valenza, e quindi gli elettroni non possono essere usati per formare un così alto numero di legami covalenti. Nei materiali metallici i pochi elettroni disponibili vengono condivisi tra molti atomi contemporaneamente. In questi solidi, gli elettroni non sono vincolati in singoli orbitali quantizzati ma sono distribuiti su “bande”: cioè un insieme di livelli energetici così ravvicinati da formare un intervallo continuo di energie possibili. L’alta conducibilità elettrica, tipica dei metalli, è l’effetto dell’alta mobilità degli elettroni in seguito a questo particolare tipo di legame.11. Le geometrie ideali e le geometrie effettive secondo la VSEPR
Le formule di Lewis ci permettono di prevedere anche la geometria molecolare, (cioè la disposizione tridimensionale degli atomi), prevedendo con buona approssimazione gli angoli di legame.La popolare teoria che permette di ricavare la geometria molecolare è nota con il suo acronimo inglese, VSEPR (Valence Shell Electron Pair Repulsion). Il successo dalla VSEPR deriva dal fatto che le sue previsioni sugli angoli di legame sono in ottimo accordo con i dati sperimentali (che possono essere misurati o tramite diffrazione ai raggi X nei solidi o grazie alla spettroscopia in fase gassosa).
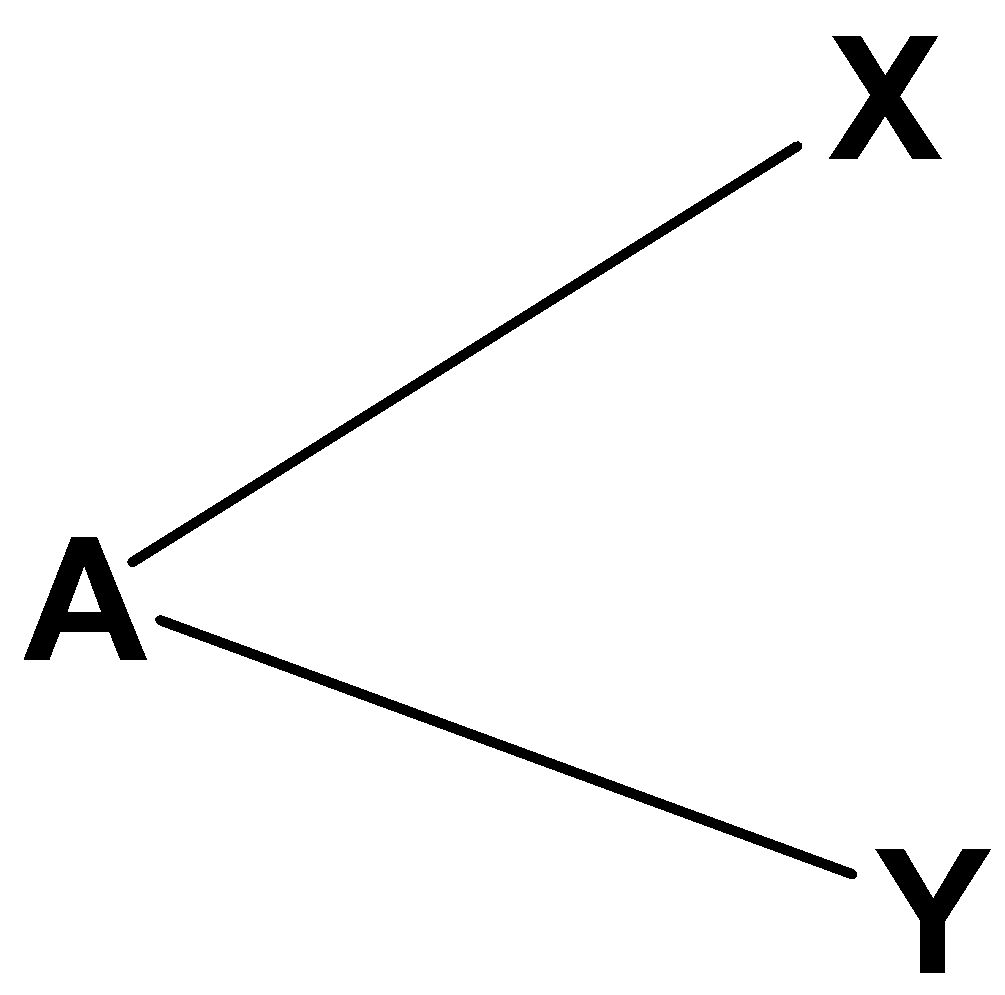
La teoria si basa sulla repulsione delle coppie elettroniche: gli elettroni sono carichi, e si respingono. Per stabilizzare la molecola gli elettroni adotteranno gli angoli più grandi possibili. Massimizzare gli angoli significa massimizzare le distanze (tra elettroni) e minimizzare le repulsioni.
I solidi tridimensionali che massimizzano gli angoli al centro sono raffigurati in tabella:
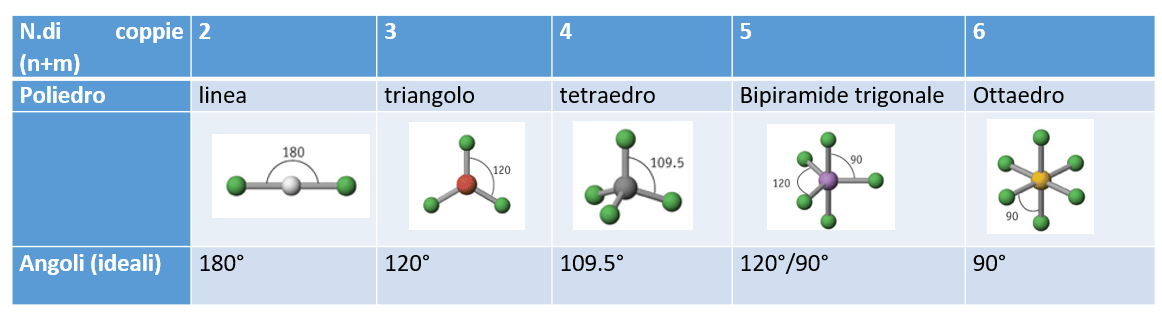
12. Le varie geometrie molecolari
Quindi, per prevedere le geometrie molecolari, bisogna:
- Contare il numero di coppie elettroniche presenti su un atomo
(e che sono rappresentate nelle formule di Lewis); - Definire la classificazione sterica della molecola AXnEm, sommando
n atomi (Xn) e m coppie di non legame (Em); - Orientare atomi e coppie verso i vertici di poliedri tridimensionali regolari;
- Ricordare che solo gli atomi sono visibili, e definiscono la geometria;
- Definire gli angoli reali: gli elettroni di non legame esercitano una repulsione maggiore, e quindi
costringono gli atomi presenti a ridurre gli angoli reali, che saranno minori degli angoli ideali.
Alcuni esempi di questi risultati sono rappresentati in figura.
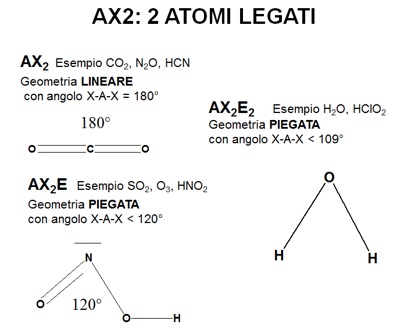 |
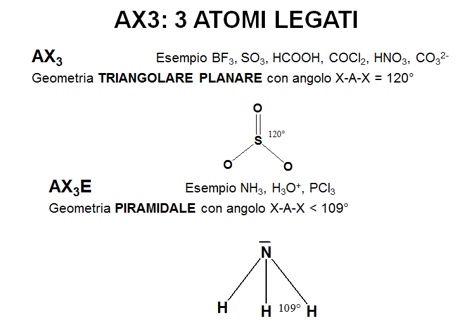 |
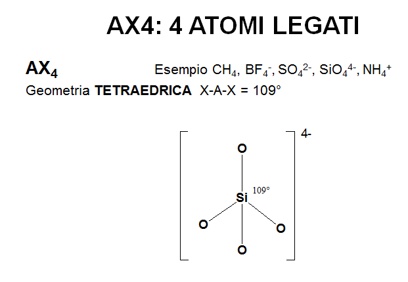 |
|---|
13. La polarità molecolare
In fisica, due cariche di segno opposto separate da una distanza fissa definiscono un dipolo elettrico. In questa situazione il prodotto delle cariche per la distanza (μ = qd) si chiama momento di dipolo elettrico. Si tratta di una grandezza vettoriale, che viene misurata in Cm (nel sistema SI) o più opportunamente in debye (1 D = 3.33 × 10-30 Cm). Bizzarramente, fisici e chimici usano convenzioni opposte sull’orientazione dei dipoli; nella maggioranza dei testi chimici i vettori sono orientati con la punta verso la carica negativa (ed un segno + sulla carica positiva, che è di notevole aiuto mnemonico).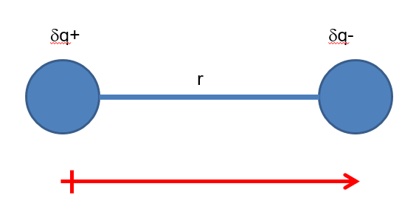
Quindi se due atomi con elettronegatività diversa formano un legame si genera un dipolo elettrico. In una molecola con molti legami i dipoli si sommano (vettorialmente) e il risultato netto dipende dalla simmetria molecolare. In molecole molto simmetriche, con atomi tutti uguali e senza coppie di non legame (AXn), la somma dei vettori ha risultante nulla in ogni direzione, e quindi il momento di dipolo elettrico molecolare è nullo. Invece molecole di bassa simmetria hanno un momento di dipolo elettrico non nullo. Si considerino ad esempio le due molecole BF3 e NF3. La differenza di elettronegatività è maggiore in BF3 che in NF3. Ma la prima ha una geometria triangolare planare e i vettori associati ai tre legami si annullano. Invece in NF3 (piramide triangolare) la componente vettoriale lungo l’asse molecolare si somma e ne risulta un momento di dipolo misurabile. Allo stesso modo, CO2 e SO2 hanno geometria diversa. La prima è lineare e apolare, la seconda è angolata e polare.
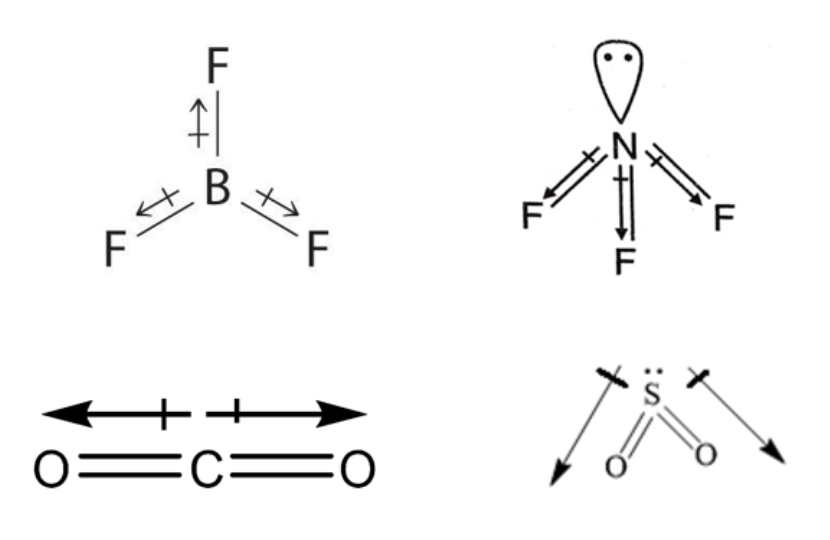
Un dipolo elettrico viene orientato da un campo elettrico esterno e quindi molecole polari e apolari hanno un comportamento diverso in presenza di un campo elettrico: le molecole polari interagiscono con un campo elettrico, e ne vengono orientate. Si parla di comportamento dielettrico.
14. Le diverse tipologie di forze intermolecolari
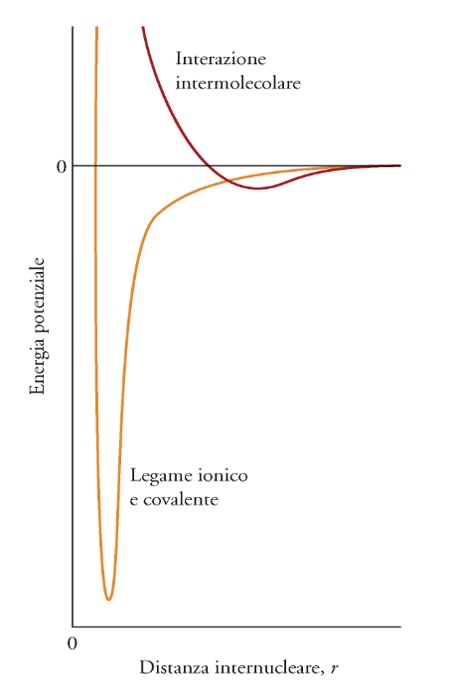
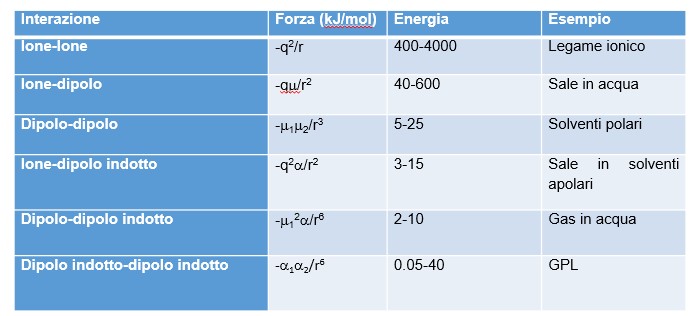
FORZE INTERMOLECOLARI
Anche le molecole possono esercitare forze elettrostatiche verso gli elettroni di altre molecole, dette generalmente forze intermolecolari o forze di van der Waals. Poiché queste forze si esercitano tra molecole (con l’ottetto completo) il principio di Pauli impedisce loro di avvicinarsi, e quindi l’energia coinvolta in questi fenomeni è minore di quella coinvolta nei legami ionici o covalenti (spesso anche molto piccola) ma si tratta comunque di fenomeni importanti, soprattutto perché la presenza di queste forze ha profonde conseguenze sul comportamento delle diverse sostanze, e ne spiega molte caratteristiche macroscopiche che ci sono familiari.
Poiché sono convolte specie di natura (e carica) diversa, anche i modelli fisici necessari per descrivere queste forze sono diversi. Ne risultano forze molto diverse per intensità che possono dipendere delle cariche presenti (q), dal momento di dipolo (p) o dalla polarizzabilità (α per le molecole apolari). Questo ultimo termine può essere definito come la capacità della materia di generare un dipolo in presenza di un campo elettrico. È chiaramente dipendente dalla mobilità degli elettroni, e quindi dal numero di elettroni posseduti, e dal volume atomico.
L’energia di queste interazioni dipende in modo diverso dalla distanza (r). Sulla base di tutte queste premesse possiamo catalogare le varie forze in un’unica tabella.
N.B.: la prima riga della tabella corrisponde alla formazione di legami ionici. Non dovrebbe essere inclusa tra le forze intermolecolari, ma è utile come termine di confronto.
- Le interazioni ione-dipolo sono quelle che si instaurano, ad esempio, quando un sale si scioglie in acqua. L’acqua può interagire efficacemente con i cationi (positivi) tramite l’atomo di ossigeno, e con gli anioni tramite gli atomi di idrogeno. L’energia coinvolta in questo processo si chiama energia di idratazione. La formazione di legami ione-dipolo avviene anche con le teste (ioniche) dei tensioattivi e rende possibile la formazione di micelle, che permettono la sospensione dei grassi (apolari) in acqua.
- Molecole polari possono interagire tra loro con una opportuna orientazione dei dipoli. Sono interazioni tipiche dei solventi organici quali acetone, etere, trielina.
- Quando una molecola apolare si trova in un campo elettrico esterno, essa può deformare la sua nuvola elettronica in modo da opporsi al campo. In questo caso si dice che si è polarizzata. L’entità di queste deformazioni è piccola, e non è costante nel tempo. Quindi, le energie coinvolte sono notevolmente minori che nei casi precedenti
- Anche le molecole apolari possono interagire tra loro tramite la polarizzazione. Le fluttuazioni (casuali) di carica su una molecola causano una polarizzazione delle molecole vicine. L’entità di queste deformazioni è maggiore, se la nuvola elettronica è estesa e poco vincolata dai nuclei atomici, cioè negli atomi con molti elettroni negli orbitali con elevati numeri quantici (n = 4, 5). Quindi le energie associate, in presenza di questi elementi, saranno maggiori. Questo effetto è evidentissimo nei punti di fusione delle molecole biatomiche degli alogeni: F2 e Cl2 sono gassosi a temperatura ambiente, Br2 è liquido, I2 è un solido. Infine, molecole di forma “allungata” avranno una superficie maggiore, in cui possono generarsi queste fluttuazioni, e interagire più efficacemente.
15. Il legame idrogeno
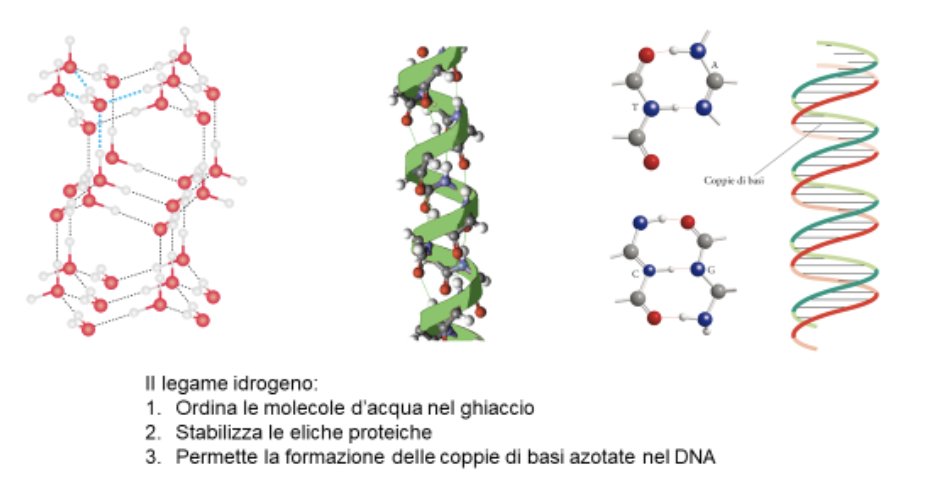
Una forma particolare di interazione dipolo-dipolo si ha quando un atomo di idrogeno è legato covalentemente ad un atomo molto elettronegativo. Poiché l’atomo di idrogeno non ha elettroni interni, la formazione del dipolo genera una carica positiva molto concentrata, che esercita una forza coulombiana molto elevata. I legami idrogeno si formano quando un atomo di idrogeno (legato ad F,O, N) interagisce con un dipolo di un’altra molecola.
Le energie coinvolte, in questa situazione, sono notevoli (10-40 kJ/mol) intermedie tra quelle tipiche delle interazioni dipolo-dipolo e quelle dei legami covalenti.
La molecola più famosa che genera legami idrogeno è l’acqua. Le proprietà dell’acqua che dipendono direttamente da questi legami sono la sua alta temperatura di ebollizione, la sua elevata capacità termica, la variazione di densità al punto di fusione.
Ma anche le molecole biologiche sfruttano i legami idrogeno. Tali legami sono sufficientemente deboli per poter essere rotti con dispendio modesto di energia, ma sufficientemente forti per poter guidare nella costruzione delle macromolecole biologiche. Le catene proteiche sono stabilizzate dalla formazione di legami idrogeno tra i gruppi ammidici e i gruppi carbonilici (N-H-----O=C). Le basi azotate nel DNA possono formare legami idrogeno solo nella giusta combinazione, e questo permette la replicazione del DNA senza errori (che causerebbero le mutazioni).