Fissaidee 1
| Site: | Federica Web Learning - LMS |
| Course: | Scienze chimiche di base |
| Unit: | Fissaidee 1 |
| Printed by: | Utente ospite |
| Date: | Tuesday, 26 August 2025, 7:01 PM |
Table of contents
- 1. La nomenclatura inorganica
- 2. La nomenclatura inorganica: i composti binari
- 3. La nomenclatura inorganica: ossidi
- 4. La nomenclatura inorganica: alogenuri, solfuri, idruri
- 5. La nomenclatura inorganica: i composti ternari
- 6. La nomenclatura inorganica: ossoanioni da ossiacidi
- 7. La nomenclatura inorganica: sali ternari di ossiacidi
- 8. La nomenclatura inorganica: la notazione IUPAC degli ossiacidi
1. La nomenclatura inorganica
I composti inorganici sono le combinazioni di elementi della tavola periodica, eccezion fatta per quelle basate sul carbonio, che sono oggetto di interesse della chimica organica.
La vasta molteplicità di sostanze inorganiche naturali, o che possono essere preparate per via sintetica, richiede la definizione di una nomenclatura accurata per garantirne l’identificazione.
Questa classificazione, per quanto complessa, può essere fatta distinguendo innanzi tutto il numero di elementi diversi che le compongono: abbiamo così composti binari, ternari (e quaternari).

Ciascuna di queste tipologie è etichettata dalla formula e da un nome. Molti nomi derivano da una consuetudine tradizionale, e tuttora resistono nella quotidianità. Per questo motivo, è bene conoscere la nomenclatura tradizionale.
La nomenclatura ufficiale IUPAC segue invece regole rigidamente codificate. Per questo, può apparire a volte macchinosa e la sua applicazione resta ancora abbastanza confinata, soprattutto, come vedremo, nel caso degli ossiacidi e dei loro sali.
2. La nomenclatura inorganica: i composti binari

I composti binari sono formati dalla combinazione di due elementi. Esempi sono l’acqua, il sale da cucina, la calce viva, l’anidride carbonica e così via.

Secondo la nomenclatura IUPAC, li identifichiamo con una formula, in cui compaiono in sequenza prima l’elemento meno elettronegativo e poi quello più elettronegativo, e con un nome, che contiene un prefisso che indica il numero di atomi di ciascun elemento (se diverso da uno), e il suffisso -uro per l’elemento più elettronegativo:
| NaCl: cloruro di sodio |
BeH2: diidruro di berillio
|
CaI2: diioduro di calcio
|
|---|---|---|
| K3N: nitruro di tripotassio |
SF4: tetrafluoruro di zolfo
|
Al2S3: trisolfuro di dialluminio |
| FeCl3: tricloruro di ferro |
FeCl2: dicloruro di ferro
|
Eccezione sono i composti dell’ossigeno, che si chiamano ossidi:
| Al2O3: triossido di dialluminio |
CO2: diossido di carbonio
|
Cl2O7: eptaossido di dicloro |
|---|---|---|
Cu2O: ossido di dirame |
CuO: ossido di rame |
La nomenclatura tradizionale è molto simile, con l’eccezione che spesso non riporta i prefissi che specificano il numero di atomi di ciascun elemento:
| NaCl: cloruro di sodio |
BeH2: idruro di berillio
|
CaI2: ioduro di calcio
|
|---|---|---|
| K3N: nitruro di potassio |
Al2S3: solfuro di alluminio
|
Nel caso di più numeri di ossidazione, la nomenclatura tradizionale prevede l’aggiunta dei due suffissi -oso e -ico, rispettivamente per il numero di ossidazione più basso e più alto:
| FeCl2: cloruro ferroso | FeCl3: cloruro ferrico |
|---|---|
| Cu2O: ossido rameoso | CuO: ossido rameico |
3. La nomenclatura inorganica: ossidi
Gli ossidi possono essere:
- ionici, se si ottengono da un metallo più ossigeno
(esempi: ossido di disodio, Na2O; ossido di calcio, CaO)
- covalenti, se si ottengono da un non metallo più ossigeno. Secondo la nomenclatura tradizionale, alcuni di essi prendono il nome di anidride, perché, messi in acqua, danno vita ai corrispondenti ossiacidi. Ecco alcuni da ricordare:
|
formula |
nomenclatura IUPAC |
nomenclatura tradizionale |
|
CO |
ossido di carbonio |
ossido di carbonio |
|
CO2 |
diossido di carbonio |
anidride carbonica |
|
N2O3 |
triossido di diazoto |
anidride nitrosa |
|
N2O5 |
pentossido di diazoto |
anidride nitrica |
|
P4O10 |
decaossido di tetrafosforo |
anidride fosforica |
|
SO3 |
triossido di zolfo |
anidride solforica |
|
Cl2O |
ossido di dicloro |
anidride ipoclorosa |
|
Cl2O7 |
eptaossido di dicloro |
anidride perclorica |
Notiamo che quando uno stesso elemento forma più di un’anidride, si aggiunge il suffisso -osa per quello che ha meno atomi di ossigeno, e -ica per quella che ne ha di più. Ciò corrisponde a diversi numeri di ossidazione dell’elemento. Quando abbiamo più di due anidridi, ci si aiuta con dei prefissi, come ipo- e per-, come capita per il cloro che forma ben quattro anidridi!
4. La nomenclatura inorganica: alogenuri, solfuri, idruri
Anche gli alogenuri e i solfuri sono composti binari e possono essere:
- ionici, se si ottengono in combinazione con un metallo. Sono chiamati anche sali perché si possono formare da reazioni di neutralizzazione acido-base. Ecco alcuni esempi:
Formula | Nomenclatura IUPAC | Nomenclatura tradizionale |
KI | ioduro di potassio | ioduro di potassio |
Na2S | solfuro di disodio | solfuro di sodio |
CaBr2 | dibromuro di calcio | bromuro di calcio |
- covalenti, se si ottengono in combinazione con un altro non metallo. Secondo la nomenclatura tradizionale, i composti con l’idrogeno (HF, HCl, HBr, HI, H2S) sono anche noti con il nome di idracidi e vengono indicati aggiungendo il suffisso -idrico al nome del non metallo. Ecco alcuni esempi:
|
Formula |
Nomenclatura IUPAC |
Nomenclatura tradizionale |
|
PBr3 |
tribromuro di fosforo |
tribromuro di fosforo |
|
CS2 |
disolfuro di carbonio |
solfuro di carbonio |
|
HF |
fluoruro di idrogeno |
acido fluoridrico |
|
HCl |
cloruro di idrogeno |
acido cloridrico |
|
HBr |
bromuro di idrogeno |
acido bromidrico |
|
HI |
ioduro di idrogeno |
acido iodidrico |
|
H2S |
solfuro di diidrogeno |
acido solfidrico |
Gli idruri sono solo ionici e si ottengono per combinazione di idrogeno con un metallo.
|
Formula |
Nomenclatura IUPAC |
Nomenclatura tradizionale |
|
KH |
idruro di potassio |
idruro di potassio |
|
CaH2 |
diidruro di calcio |
idruro di calcio |
|
AlH3 |
triidruro di alluminio |
idruro di alluminio |
5. La nomenclatura inorganica: i composti ternari
I composti ternari sono formati dalla combinazione di tre elementi.
Gli idrossidi sono composti ionici formati dall’anione OH– e un catione metallico, tipicamente dei Gruppi 1 e 2. Esempi sono: idrossido di sodio, NaOH; idrossido di potassio, KOH; idrossido di calcio, Ca(OH)2; idrossido di alluminio, Al(OH)3.
Gli ossiacidi sono composti molecolari contenenti ossigeno, idrogeno e un elemento non metallico E, tipicamente dei gruppi 14, 15, 16 e 17. Pertanto, hanno formula molecolare HnEOm(E= C, N, P, S, Cl…).
Secondo la nomenclatura tradizionale, che in questi casi risulta nettamente più diffusa, gli ossiacidi prendono il nome dalle corrispondenti anidridi, dalle quali vengono ottenuti per reazione con l’acqua. Se prendiamo in considerazione le anidridi elencate nella precedente slide, avremo:
anidride | acido | ||
formula | nome tradizionale | Formula | nome tradizionale |
CO2 | anidride carbonica | H2CO3 | acido carbonico |
N2O3 | anidride nitrosa | HNO2 | acido nitroso |
N2O5 | anidride nitrica | HNO3 | acido nitrico |
P4O10 | anidride fosforica | H3PO4 | acido fosforico |
SO3 | anidride solforica | H2SO4 | acido solforico |
Cl2O | anidride ipoclorosa | HClO | acido ipocloroso |
Cl2O7 | anidride perclorica | HClO4 | acido perclorico |
In tutti gli ossiacidi, i numeri di ossidazione degli elementi non cambiano rispetto a quelli dei corrispondenti ossidi.
6. La nomenclatura inorganica: ossoanioni da ossiacidi
Gli ossiacidi possono cedere uno o più H+ perché si comportano da acidi di Brønsted. Gli anioni poliatomici che ne derivano prendono il nome dell’acido sostituendo la desinenza -oso con -ito, e la desinenza -ico con -ato. Inoltre, qualora contengano ancora atomi di idrogeno, ne viene specificata la presenza e il numero. Ecco alcuni anioni poliatomici da ricordare:
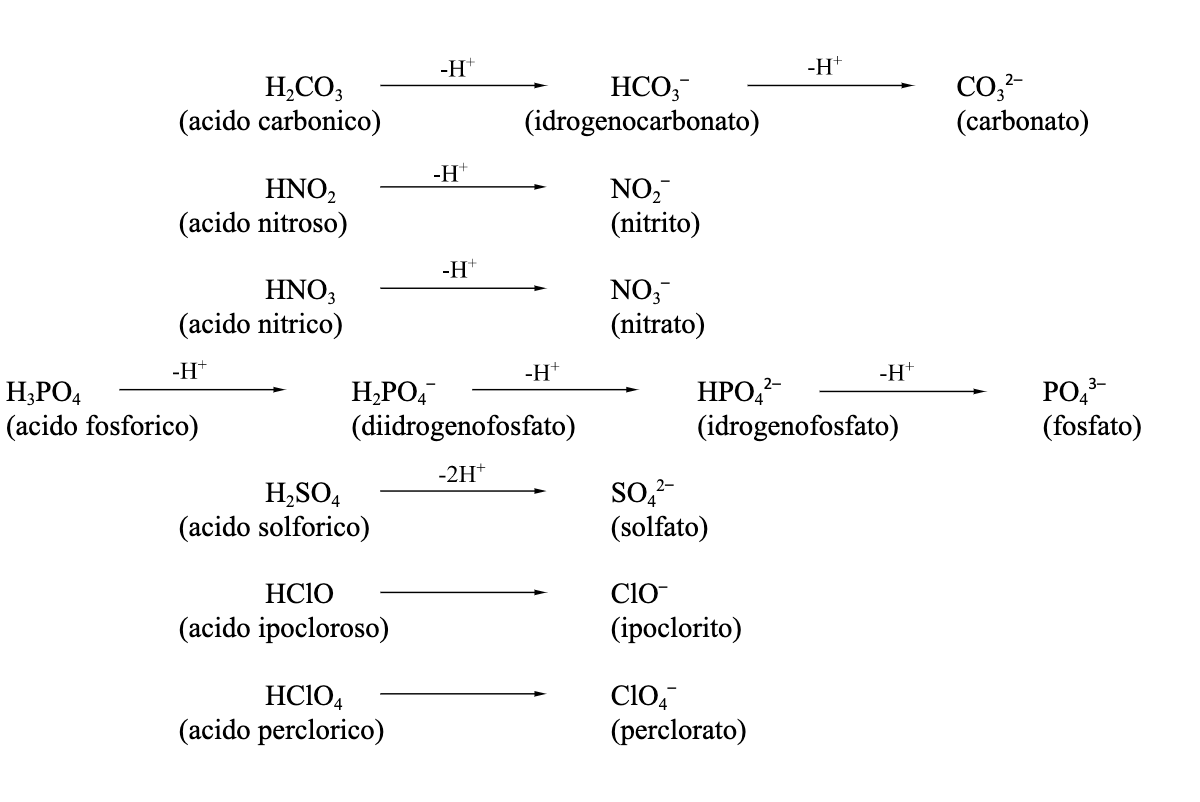
7. La nomenclatura inorganica: sali ternari di ossiacidi

Gli anioni poliatomici degli ossiacidi possono formare composti ionici ternari (sali) con i cationi metallici. Ecco alcuni esempi:
sali ternari di ossiacidi | |
formula | nome tradizionale |
CaCO3 | carbonato di calcio |
Na2CO3 | carbonato di sodio |
KNO3 | nitrato di potassio |
Ca3(PO4)2 | fosfato di calcio |
Na2SO3 | solfito di sodio |
Al2(SO4)3 | solfato di alluminio |
CuSO4 | solfato di rame |
NaClO | ipoclorito di sodio |
KClO4 | perclorato di potassio |
Qualora l’anione poliatomico contenga ancora un atomo di idrogeno, si hanno addirittura composti quaternari, contenenti cioè atomi di quattro elementi diversi: NaHCO3, idrogenocarbonato di sodio.
8. La nomenclatura inorganica: la notazione IUPAC degli ossiacidi
I nomi che abbiamo finora dato agli ossiacidi e ai corrispondenti anioni poliatomici sono quelli della nomenclatura tradizionale. Per completezza, facciamo cenno anche alla notazione IUPAC, che, in questi casi, è ancora scarsamente applicata.
I nomi degli acidi hanno tutti la desinenza -ico, ma viene specificato il numero di atomi di ossigeno presenti, nonché lo stato di ossidazione dell’elemento E. Gli anioni poliatomici seguono la stessa regola, e hanno tutti la desinenza -ato. Ecco una tabella in cui sono riportate entrambe le notazioni:
Formula | Nomenclatura tradizionale | Nomenclatura IUPAC |
H2CO3 | acido carbonico | acido triossocarbonico(IV) |
HNO2 | acido nitroso | acido diossonitrico(III) |
HNO3 | acido nitrico | acido triossonitrico(V) |
H3PO4 | acido fosforico | acido tetraossofosforico(V) |
H2SO4 | acido solforico | acido tetraossosolforico(VI) |
HClO | acido ipocloroso | acido monossoclorico(I) |
HClO4 | acido perclorico | acido tetraossoclorico(VII) |
HCO3– | idrogenocarbonato | idrogenotriossocarbonato(IV) |
CO32– | carbonato | triossocarbonato(IV) |
NO2– | nitrito | diossonitrato(III) |
NO3– | nitrato | triossonitrato(V) |
PO43– | fosfato | tetraossofosfato(V) |
SO42– | solfato | tetraossosolfato(VI) |
ClO– | ipoclorito | monoossoclorato(I) |
ClO4– | perclorato | tetraossoclorato(VII) |
Ecco alcuni esempi di sali ternari formati dagli anioni poliatomici secondo la nomenclatura IUPAC:
Formula | Nomenclatura IUPAC |
CaCO3 | triossocarbonato(IV) di calcio |
Na2CO3 | triossocarbonato(IV) di disodio |
KNO3 | triossonitrato(V) di potassio |
Ca3(PO4)2 | ditetraossofosfato(V) di tricalcio |