Fissaidee 2
| Site: | Federica Web Learning - LMS |
| Course: | Scienze chimiche di base |
| Unit: | Fissaidee 2 |
| Printed by: | Utente ospite |
| Date: | Tuesday, 26 August 2025, 7:01 PM |
Table of contents
- 1. Le proprietà dei composti inorganici
- 2. Proprietà fisiche dei composti binari ionici
- 3. Proprietà chimiche dei composti binari ionici
- 4. Proprietà fisiche dei composti binari covalenti
- 5. Proprietà fisiche dei composti binari covalenti: l’acqua
- 6. Proprietà chimiche dei composti binari covalenti
- 7. Proprietà degli ossiacidi
- 8. Proprietà dei sali degli ossiacidi
- 9. Il colore dei composti inorganici
1. Le proprietà dei composti inorganici
Descrivere le proprietà dei composti inorganici è una avventura ardua e stimolante. La varietà di combinazioni che è possibile formulare con le decine di elementi che affrescano la tavola periodica è così ampia che sono possibili tutte le sfumature di comportamento, che vanno da estrema durezza a spiccata fragilità, da refrattarietà e resistenza chimica a volatilità e reattività, da altissima conducibilità elettrica a elevato potere isolante. Altre qualità ci affascinano e sorprendono, come le stupefacenti gradazioni di colore di cui a volte si vestono i composti inorganici.
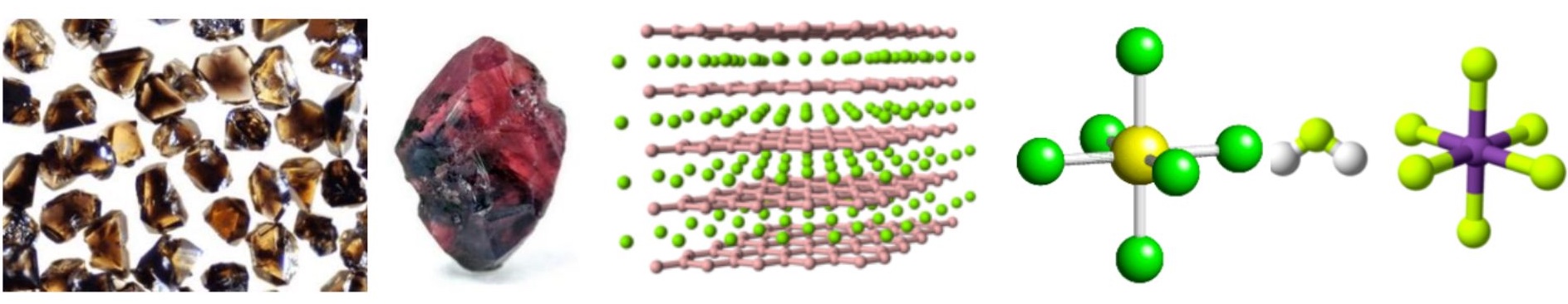
In sequenza: nitruro di boro, uno dei materiali più duri che esistano; ossido di alluminio: materiale refrattario, ma anche gemma preziosa (rubino);
la struttura del boruro di magnesio, uno dei superconduttori convenzionali più efficaci;
la struttura dell’esafluoruro di zolfo, efficiente isolante elettrico;
la struttura dell’acido esafluoroantimonico, l’acido più corrosivo che esista.
Allo stesso modo, un elenco esaustivo delle loro applicazioni non è facilmente compilabile, perché i composti inorganici si sposano bene con tutti i settori della tecnologia e delle scienze, come quelli elettronico, sensoristico, biomedico, automobilistico, aerospaziale, industriale, solo per citarne alcuni.
A dispetto di questa molteplicità, è tuttavia possibile generalizzarne importanti proprietà chimiche e fisiche alla luce della natura dei legami chimici che si instaurano tra gli atomi o gli ioni in essi presenti.
2. Proprietà fisiche dei composti binari ionici
La combinazione di un elemento dei primi gruppi con un elemento degli ultimi gruppi della tavola periodica restituisce composti binari ionici. La loro struttura cristallina è caratterizzata dall’alternanza ordinata di ioni positivi e ioni negativi che si attirano in virtù delle cariche di segno opposto.
Tipici cationi e anioni sono quelli che presentano la configurazione elettronica otteziale grazie all’acquisto o alla cessione di 1, 2 o 3 elettroni, secondo il gruppo di appartenenza:

Esempi di composti ionici sono: NaCl, cloruro di sodio; CaCl2, cloruro di calcio, K2O, ossido di potassio, LiH, idruro di litio; Na2S, solfuro di sodio e così via.
Le proprietà fisiche riflettono la natura del legame del legame ionico:
- hanno alti punti di fusione, perché solo a temperature elevate è possibile rendere mobili gli ioni (Vedi il video).

- sono spesso solubili in acqua, perché quest’ultima è capace di idratare gli ioni grazie alla sua spiccata polarità;
- sono fragili, perché, in seguito a un urto, ioni dello stesso segno si affacciano l’un con l’altro, e la repulsione che ne deriva sfalda il cristallo.

3. Proprietà chimiche dei composti binari ionici
Ossidi e idruri ionici reagiscono prontamente con l’acqua. I primi formano i corrispondenti idrossidi, secondo le seguenti stechiometrie nel caso degli ossidi degli elementi dei gruppi 1 e 2, MI e MII:
Esempi: |
\( M^{I}_{2}O_{(aq)} + H_{2}O_{(l)} → 2 M^{I}OH_{(aq)} \) |
\( M^{II}_{2}O_{(aq)} + H_{2}O_{(l)} → 2 M^{II}OH_{2(aq)} \) |
|---|---|---|
| \( Na_{2}O_{(aq)} + H_{2}O_{(l)} → 2 NaOH_{(aq)} \) | \( CaO_{(aq)} + H_{2}O_{(l)} → Ca(OH)_{2(aq)} \) |
La reazione è fortemente esotermica (vedi il video):
È possibile scrivere entrambe le reazioni in forma ionica, evidenziando il ruolo delle sole specie reattive:
 | \( O^{2-}_{(aq)} + H_{2}O_{(l)} = 2 OH^{-}_{(aq)} \) |
|---|
Anche gli idruri ionici formano idrossidi in acqua, con contemporanea formazione di idrogeno gassoso, che si rivela con le classiche bollicine:
Esempi: | \( M^IH_{(aq)} + H_2O_{(l)} → M^{I}OH_{(aq)} + H_{2(g)}↑ \) | \( M^{II}H_{2(aq)}+ 2H_2O_{(l)} → M^{II}(OH)_{2(aq)} + 2H_{2(g)}↑ \) |
|---|---|---|
| \( LiH_{(aq)} + H_2O_{(l)} → LiOH_{(aq)} + H_{2(g)}↑ \) | \( CaH_{2(aq)} + 2H_2O_{(l)} → Ca(OH)_{2(aq)} + 2H_{2(g)}↑ \) |
In forma ionica:
\( H^-_{(aq)} + H_2O_{(l)} → OH^-_{(aq)} + H_{2(g)}↑ \)
L’idrogeno che si libera può incendiarsi a contatto con l’ossigeno dell’aria (vedi il video):
\( 2H_{2(g)}+ O_{2(g)}\rightarrow 2H_2O_{(g)} \)
4. Proprietà fisiche dei composti binari covalenti
La combinazione di due elementi posti a destra nella tavola periodica (Gruppi 14-17) restituisce composti binari molecolari.

A differenza di quelli ionici, i composti binari molecolari presentano un’ampia varietà di strutture e proprietà fisiche.
Molti ossidi sono gassosi (come CO, CO2, NO, NO2) o sono solidi bassofondenti (come N2O5, SO3). In altri casi, tuttavia, possono dar vita a specie refrattarie come la silice, SiO2, che fonde a 1710°C.
Il motivo è legato alla diversa natura dei legami intermolecolari: per esempio, mentre allo stato solido le molecole apolari di diossido di carbonio interagiscono molto debolmente (e il solido, detto ghiaccio secco, sublima già a temperatura ambiente), il diossido di silicio è un solido reticolare con una rete estesa di legami Si–O.
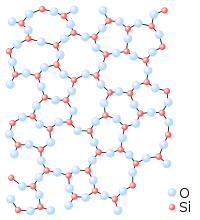
5. Proprietà fisiche dei composti binari covalenti: l’acqua
Appartengono a questa categoria di composti anche quelli contenenti idrogeno, come gli alogenuri HF, HCl, HBr e soprattutto l’acqua, H2O, le cui proprietà uniche e spettacolari sono un riflesso dell’elevata differenza di elettronegatività tra ossigeno e idrogeno e della geometria angolata.
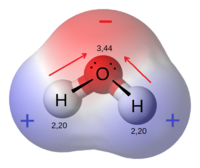
L’elevata polarità che ne deriva consente di instaurare interazioni dipolo-dipolo note con il nome di legame a idrogeno, in cui l’atomo di idrogeno è a ponte tra l’atomo di ossigeno a cui è legato covalentemente e un atomo di ossigeno di una molecola adiacente.
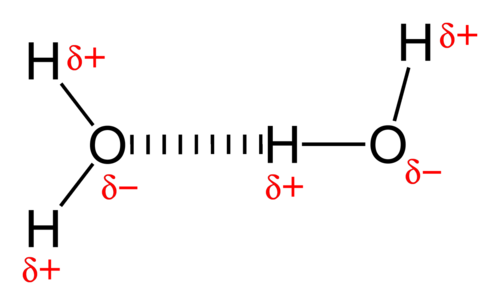
Allo stato solido, i legami a idrogeno impegnano gli atomi di idrogeno e di ossigeno di tutte le molecole d’acqua presenti nel cristallo, al punto che ciascuna di esse è impegnata in quattro legami a idrogeno.
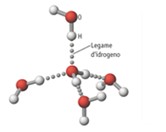
Per realizzare questa fitta trama, le molecole devono distanziarsi le une dalle altre, e la struttura si espande: questo restituisce al ghiaccio la proprietà singolare di essere meno denso dell’acqua liquida, e quindi di galleggiarvi.
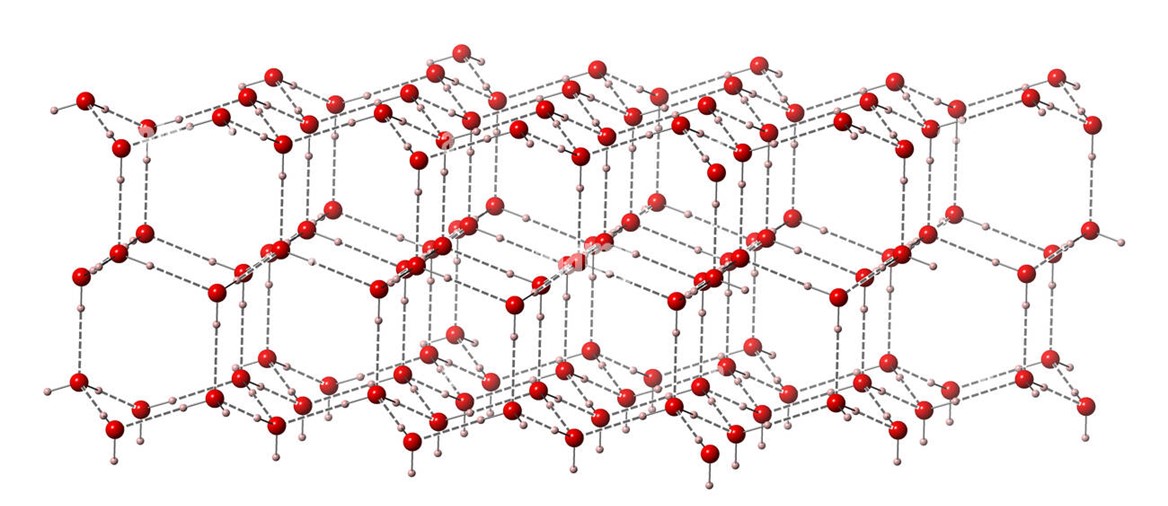
Altre peculiari proprietà dell’acqua sono il punto di ebollizione e il calore di evaporazione insolitamente alti, e la capacità del ghiaccio di fondere se sottoposto a pressione.
6. Proprietà chimiche dei composti binari covalenti
Gli ossidi covalenti, al pari degli ossidi ionici, possono reagire con l’acqua. In questo caso, vengono comunemente definiti anidridi, termine di origine greca che vuol dire letteralmente ‘privo di acqua’.
L’esito della reazione è tuttavia molto diverso, perché nel caso delle anidridi il prodotto è il corrispondente ossiacido, vale a dire un composto ternario formato H, O e l’elemento non metallico.
CO2 + H2O = H2CO3 (anidride carbonica) (acido carbonico) |
|---|
SiO2 + 2H2O = H4SiO4 (anidride silicica) (acido silicico) |
N2O3 + H2O = 2 HNO2 (anidride nitrosa) (acido nitroso)N2O5 + H2O = 2 HNO3 (anidride nitrica) (acido nitrico) |
P4O10 + 6 H2O = 4 H3PO4 (anidride fosforica) (acido fosforico) |
SO3 + H2O = H2SO4 (anidride solforica) (acido solforico) |
Cl2O + H2O = 2 HClO (anidride ipoclorosa) (acido ipocloroso) |
Cl2O7 + H2O = 2 HClO4 (anidride perclorica) (acido perclorico) |
Alcuni ossidi covalenti non reagiscono con l’acqua: esempi notevoli sono CO e NO.
Ecco le strutture di alcuni ossidi covalenti:
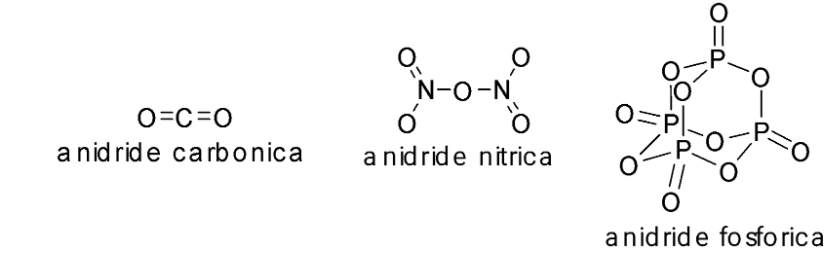
L’anidride fosforica, per la sua capacità di reagire prontamente con l’acqua, è usata come potente disidratante.
7. Proprietà degli ossiacidi
Gli ossiacidi sono composti molecolari contenenti ossigeno, idrogeno e un elemento non metallico E, tipicamente dei gruppi 14, 15, 16 e 17. Pertanto, hanno formula molecolare HnEOm (E= C, N, P, S, Cl…).
La loro struttura prevede l’atomo dell’elemento non metallico legato agli atomi di ossigeno e gli atomi di idrogeno legati a quelli di ossigeno (con rare eccezioni). Ecco alcuni esempi:
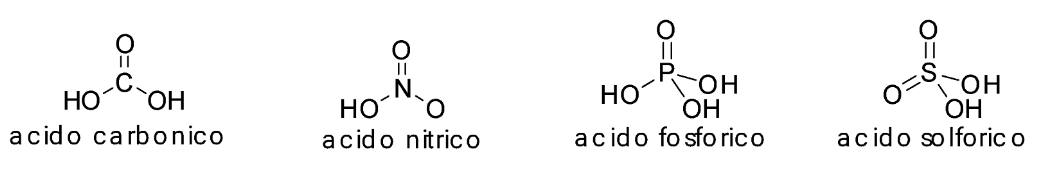
Gli ossiacidi sono ampiamente presenti nella nostra vita quotidiana:
- l’acido carbonico, H2CO3, si trova nelle acque minerali e inoltre ha un ruolo chiave nel mantenere costante il pH del nostro sangue.
- l’acido nitrico, HNO3, è un prodotto base dell’industria chimica, perché da esso si preparano i fertilizzanti.
- l’acido fosforico, H3PO4, è usato come acidificante nelle bevande come la Coca-Cola, ed è anch’esso usato per produrre fertilizzanti.
- l’acido solforico, H2SO4, si trova nelle batterie delle automobili, e trova impiego nella manifattura di un ampio numero di materiali.
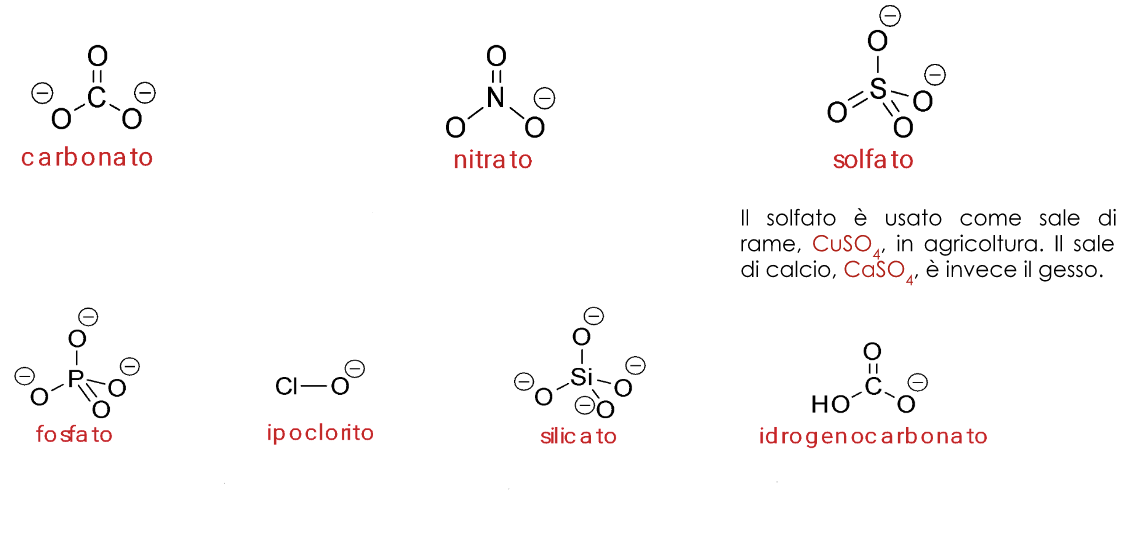
8. Proprietà dei sali degli ossiacidi
Per reazione tra ossiacidi e idrossidi di cationi metallici, o tra anidridi e ossidi ionici si ottengono sali ternari (o quaternari), composti ionici in cui l’anione deriva dalla deprotonazione dell’ossiacido, e il catione è uno ione positivo di un elemento metallico. Esempi:
| HNO3 + KOH → KNO3 + H2O | 2 H3PO4 + 3 Ca(OH)2 → Ca3(PO4)2 + 6 H2O |
|---|---|
| SO3 + CuO → CuSO4 | Cl2O + Na2O → 2 NaClO |
Molti sali si ritrovano in natura, e alcuni di essi trovano importante impiego nella nostra vita quotidiana
9. Il colore dei composti inorganici
Sin dall’antichità, l’uomo è stato attirato dalle splendide pietre naturali, e ne ha fatto uso per impreziosire gioielli e decorazioni. Oltre alla loro eccezionale durezza, è il meraviglioso colore che incanta e accende la nostra immaginazione

Queste gemme sono composti inorganici (tipicamente ossido di alluminio o silicati) che contengono tracce di cationi di metalli di transizione, come Ti(IV), Fe(III), Fe(II), Cr(III). Proprio queste impurezze sono responsabili del colore, perché la loro configurazione elettronica termina con elettroni in orbitali 3d semipieni. Quando la radiazione solare attraversa un campione di minerale, questi elettroni ne assorbono frequenze nella porzione del visibile, per saltare in un orbitale 3d vuoto. La radiazione luminosa giunge quindi ai nostri occhi impoverita da queste componenti, e ci appare del colore della radiazione che riesce ad attraversarlo. Per esempio, se il campione assorbe la radiazione colorata nella frequenza del verde, ci apparirà di colore rosso.