Fissaidee 3
| Sito: | Federica Web Learning - LMS |
| Corso: | Scienze chimiche di base |
| Unit: | Fissaidee 3 |
| Stampato da: | Guest user |
| Data: | martedì, 26 agosto 2025, 21:25 |
Indice Unit
- 1. I sistemi a due o più componenti: le soluzioni e i sistemi eterogenei
- 2. Le soluzioni liquide
- 3. L’espressione della concentrazione
- 4. L’espressione della concentrazione: percentuale in peso e in volume
- 5. L’espressione della concentrazione: percentuale in massa/volume e ppm
- 6. L’espressione della concentrazione: la molarità, la molalità e la frazione molare
- 7. Il processo di dissoluzione
- 8. Il processo di dissoluzione è un equilibrio dinamico: solubilità e soluzioni sature
- 9. La solubilità dipende dalla natura del solvente e del soluto
- 10. La solubilità dipende dalla temperatura
- 11. La solubilità dipende dalla pressione
1. I sistemi a due o più componenti: le soluzioni e i sistemi eterogenei
Nel mondo in cui viviamo, le sostanze chimiche sono spesso combinate tra loro, e il loro mescolamento produce sistemi con proprietà molto differenti da quelle delle stesse sostanze prese singolarmente: esempi sono il latte, una bevanda come la Coca-Cola, la margarina, il bronzo, l’acqua marina, l’aria

Il mescolamento di due o più sostanze può dar vita alle soluzioni, vale a dire miscele omogenee che si presentano in un’unica fase: una fase è una porzione di materia le cui proprietà (colore, densità…) sono costanti in tutti i suoi punti.
Le soluzioni possono essere solide (l’acciaio), liquide (l’acqua del mare) o gassose (l’aria). I componenti di una soluzione non sono separabili tramite semplici procedure meccaniche, come filtrazione o centrifugazione, ma solo attraverso procedure più complesse, che prevedono l’introduzione di calore o altre sostanze.
D’altro canto, dall’unione di due o più sostanze si possono ottenere anche miscele eterogenee, in cui le sostanze sono in fasi diverse, vale a dire sono macroscopicamente separate: è questo il caso della sabbia in un bicchiere d’acqua, o del sistema acqua/olio. I componenti di un sistema eterogeno sono separabili tramite semplici procedure meccaniche, come filtrazione o centrifugazione.
2. Le soluzioni liquide
Le soluzioni liquide sono quelle che hanno particolare rilevanza nella nostra vita quotidiana: soluzioni liquide sono la benzina, l’olio, l’acetone per smacchiare le unghie, l’aceto, molte bevande, l’acqua del mare.
Nelle soluzioni liquide si riconosce spesso un componente più abbondante (solvente) e uno o più componenti presenti in minor quantità (soluti). Per esempio, nelle soluzioni acquose, su cui si basano anche i sistemi biologici, l’acqua ha il ruolo di solvente, mentre il soluto può essere un composto molecolare, come lo zucchero, o un composto ionico, come il sale da cucina:
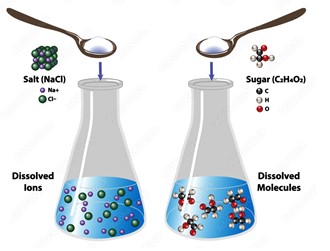
In questo secondo caso, la soluzione conduce bene l’elettricità a causa della presenza degli ioni provenienti dalla sua dissociazione.
A volte la distinzione tra solvente e soluto è più sfumata: per esempio, quando si mescolano due liquidi completamente miscibili, come acqua e alcol etilico, i ruoli possono invertirsi secondo la composizione della miscela, o non essere definibili quando i due componenti sono presenti in quantità simili.
3. L’espressione della concentrazione
Le proprietà di una soluzione dipendono non solo dalla natura chimica di solvente e di soluto, ma anche dalla quantità con cui essi sono presenti in una soluzione. La grandezza che esprime questa seconda informazione è la concentrazione (C). Si dice che una soluzione concentrata contiene maggior quantità di soluto di una soluzione diluita

Numericamente, il valore di concentrazione di una soluzione può essere espresso in diversi modi, secondo le unità con cui si indicano le quantità dei suoi componenti:
- percentuale in peso
- percentuale in volume
- percentuale massa/volume
- parti per milione
- molarità
- molalità
- frazione molare
Le prime quattro sono quelle con cui vengono tipicamente espresse le concentrazioni di prodotti commerciali o di uso quotidiano, come bevande e detersivi. Infatti, si riferiscono a unità di misura di uso comune, come il grammo o il litro.
Le ultime tre sono definibili introducendo il concetto di mole, e quindi sono usate in ambito tecnico-scientifico, dove assumono grande importanza anche nel definire importanti proprietà delle soluzioni. Chiaramente è possibile convertire il valore di concentrazione da un modo all’altro attraverso semplici passaggi.
4. L’espressione della concentrazione: percentuale in peso e in volume
La percentuale in peso è definita come la massa di soluto (in grammi) presente in cento grammi di soluzione (o multipli e sottomultipli del grammo). Si indica con il simbolo %w/w, ed è adimensionale:
%w/w = \( \frac{massa_{soluto} (g)}{massa_{soluzione} (g)}\times100 \)
Per esempio, una soluzione acquosa di saccarosio (C12H22O11) al 15%w/w contiene 15 grammi di zucchero in ogni 100 grammi di soluzione (e quindi in 100 – 15 = 85 g di acqua).

La percentuale in volume è definita come il volume di soluto (in mL) presente in cento millilitri di soluzione (o multipli e sottomultipli del millilitro). Si indica con il simbolo %v/v, ed è adimensionale:
%v/v = \( \frac{volume_{soluto} (mL)}{volume_{soluzione} (mL)}\times100 \)
Si usa quando soluto e solvente sono entrambi liquidi. Per esempio, una soluzione acquosa di etanolo al 25%v/v contiene 25 mL di alcol in ogni 100 mL di soluzione.

Contiene 25 mL di etanolo
5. L’espressione della concentrazione: percentuale in massa/volume e ppm
La percentuale massa/volume esprime la massa di soluto in grammi presente in 100 mL di soluzione (o multipli e sottomultipli di queste unità). Si indica con %m/V:
%m/V= \( \frac{massa_{soluto} (g)}{volume_{soluzione} (mL)}\times100 \)
È una delle espressioni più usate nelle soluzioni di uso commerciale. Per esempio, l’aceto alimentare ha una concentrazione di acido acetico pari a 6%m/V il che implica la presenza di 6 grammi di acido acetico in 100 mL di aceto.
L’espressione ppm indica invece parti per milione, vale a dire i milligrammi di soluto presenti in un chilogrammo di soluzione (o multipli e sottomultipli di queste unità).
\( ppm= \frac{massa_{soluto} (mg)}{massa_{soluzione} (kg)} \)
Si usa quando le soluzioni sono molto diluite, e quindi il soluto è presente in tracce. È il caso di inquinanti nelle acque che non devono superare certi valori di ppm per consentirne l’uso. Ad esempio, nelle acque potabili lo ione nitrato non può superare la concentrazione di 50 ppm, cioè 50 mg per chilogrammo (che corrisponde in questo caso a un litro).
6. L’espressione della concentrazione: la molarità, la molalità e la frazione molare
La molarità è definita come il numero di moli di soluto presenti in un litro di soluzione. Si indica con il simbolo M, e la sua unità di misura è mol/L:
\( C(M)= \frac{n_{soluto} (mol)}{V_{soluzione} (L)} \)
Per esempio, una soluzione acquosa di solfato di rame (CuSO4) 0,40 M contiene 0,40 moli di solfato di rame (pari a 64 g) in ogni litro di soluzione .

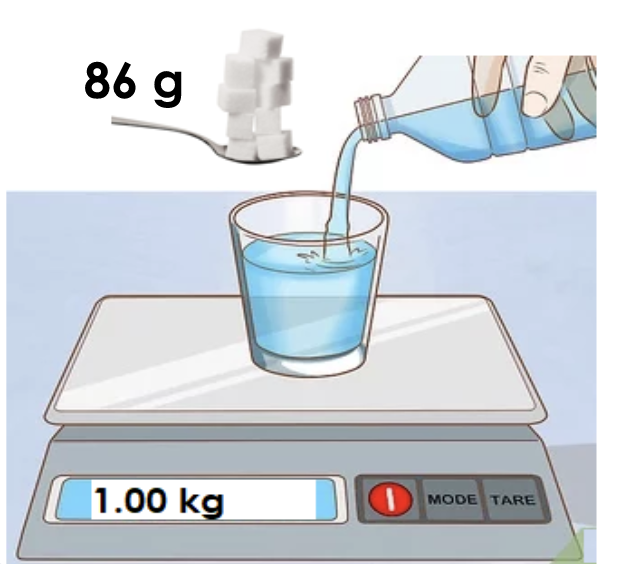
La molalità è definita come il numero di moli di soluto presenti in un chilogrammo di soluzione. Si indica con il simbolo m, e la sua unità di misura è mol/kg:
\( C(m)= \frac{n_{soluto} (mol)}{V_{solvente} (kg)} \)
Per esempio, una soluzione acquosa di saccarosio (C12H22O11) 0,25 m contiene 0,25 moli di zucchero (pari a 86 g) in ogni chilogrammo di acqua.
La frazione molare di un componente \( i \) di una soluzione è definita come il numero di moli del componente \( i \) diviso la somma delle moli di tutti i componenti. Si indica con il simbolo \( x \), ed è adimensionale:
\( x_i= \frac{n_{i} (mol)}{n_{totali} (mol)} \)
È un numero compreso tra 0 e 1, dove 0 e 1 rappresentano due casi limite: è 0, quando il componente \( i \) è assente; è 1, quando c’è solo il componente \( i \), e quindi si tratta di una sostanza pura.
7. Il processo di dissoluzione
È esperienza comune che, aggiungendo un po’ di sale a un bicchiere d’acqua, ne vediamo i cristalli sparire al suo interno, fino a ottenere una soluzione liquida omogenea.

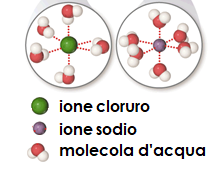
Cosa è successo? Quando aggiungiamo i primi granelli di sale, le molecole d’acqua si avvicinano ai cristalli e ne smantellano il reticolo ionico: gli ioni Na+ e Cl– passano in soluzione circondati da molecole d’acqua che si orientano con la polarità di segno opposto, instaurando con gli ioni una interazione forte ione-dipolo permanente: gli ioni cloruro, negativi, sono circondati da molecole di acqua che si avvicinano tramite gli atomi di idrogeno (sede di una parziale carica positiva), mentre gli ioni sodio, positivi, sono circondati da molecole di acqua che si avvicinano attraverso gli atomi di ossigeno (sede di una parziale carica negativa). Gli ioni si trovano, così idratati, all’interno della soluzione.
Se però insistiamo nell’aggiunta, a un certo punto i cristalli di sale non si scioglieranno più, e li vedremo depositarsi sul fondo del bicchiere. Continuando ad aggiungere, il deposito sul fondo aumenta sempre di più. Apparentemente, il sistema bifasico, costituito dalla soluzione e dai granelli indisciolti, resta in quiete.

8. Il processo di dissoluzione è un equilibrio dinamico: solubilità e soluzioni sature
In realtà, il sistema eterogeneo, in cui sono chiaramente visibili i cristalli di sale indisciolto, è animato da un movimento incessante a livello microscopico : in un dato intervallo di tempo, una certa quantità di ioni presenti in soluzione si deposita sulla superficie dei cristalli, mentre una stessa quantità di ioni la lascia, rientrando idratata in soluzione
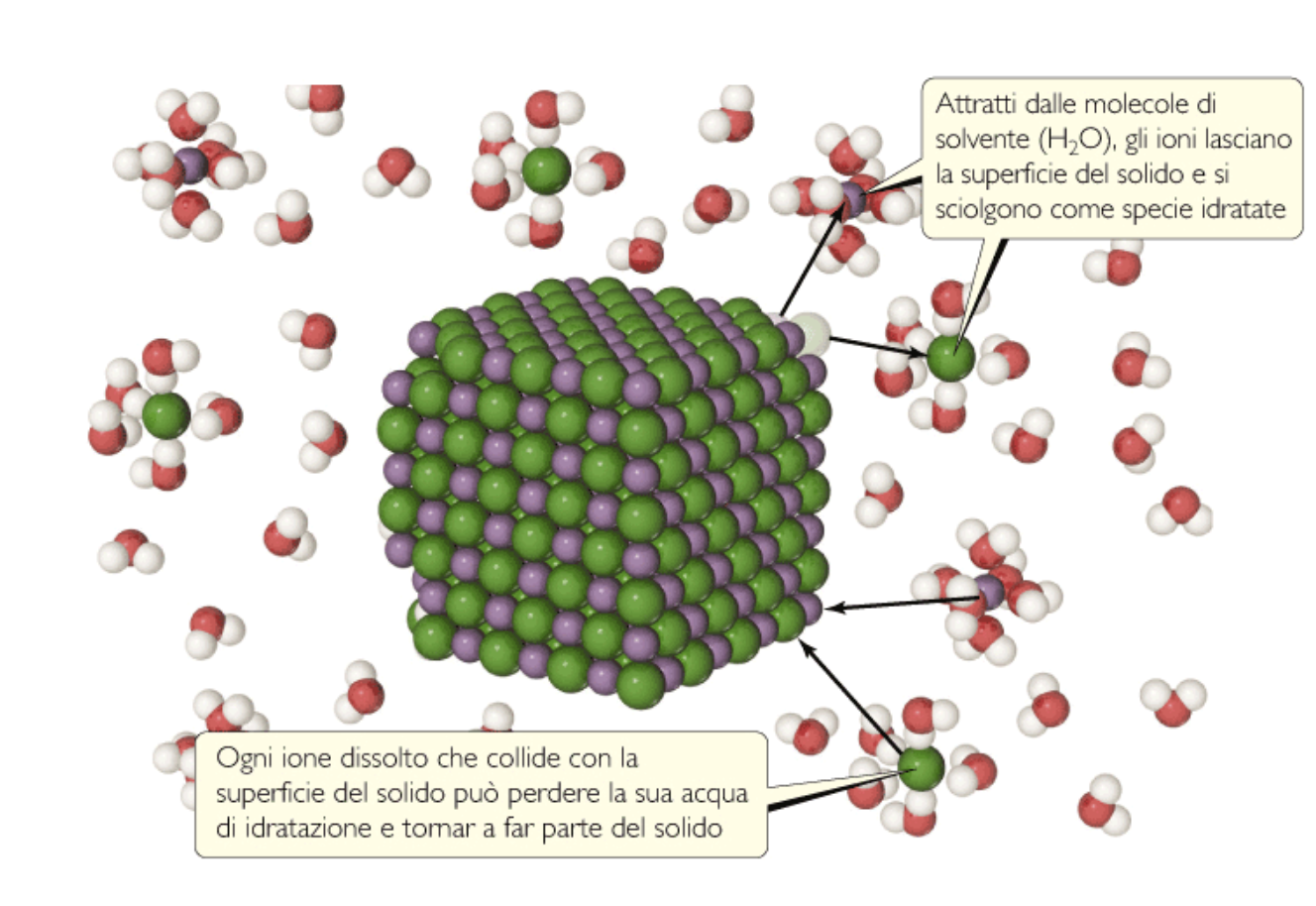
Si stabilisce quindi un equilibrio dinamico, vale a dire i due processi opposti (dissoluzione e precipitazione) avvengono alla stessa velocità, e la concentrazione della soluzione resta quindi costante.
In queste condizioni, la soluzione si definisce satura, e la sua concentrazione esprime la solubilità del soluto, che coincide quindi con la massima quantità di soluto che si scioglie in un dato volume di solvente a una certa temperatura.
9. La solubilità dipende dalla natura del solvente e del soluto
La solubilità di un soluto in un solvente dipende da tre fattori: natura di soluto e solvente, temperatura e pressione.
Nel primo caso, vale la regola che il simile scioglie il simile: solventi polari sciolgono bene sostanze polari e ioniche, mentre solventi poco polari o apolari sciolgono bene sostanze altrettanto poco polari. Infatti, affinché una sostanza si sciolga bene in un’altra, è necessario che le interazioni solvente-soluto (che si vanno a instaurare) siano tali da compensare la rottura delle forze intermolecolari preesistenti nel solvente e nel soluto puri.
Quindi l’acqua, sostanza molto polare e capace di formare legami a idrogeno, scioglierà bene sia composti ionici (come NaCl) sia molecole polari (come il glucosio). Nel primo caso, il legame ionico preesistente nel sale viene demolito a favore di forti interazioni ioni-dipolo permanente (descritte nella slide precedente). Nel secondo caso, l’acqua scioglie bene lo zucchero perché stabilisce legami a idrogeno con i gruppi –OH in esso presenti.
Invece, un solvente apolare, come un idrocarburo o una miscela di essi (la benzina), scioglie sostanze apolari, con le quali instaura interazioni di tipo dipolo indotto-indotto, analoghe a quelle presenti nei due componenti separati. Ecco perché le macchie di unto e di olio vengono via bene con la benzina.
10. La solubilità dipende dalla temperatura
La dipendenza della solubilità dalla temperatura dipende da un complesso bilancio energetico, che tiene conto della forza delle interazioni solvente-solvente, soluto-soluto e solvente-soluto, nonché di fattori entropici, cioè legati all’aumento del disordine quando si mescolano due sostanze.
Per questo motivo, la dipendenza non è facilmente generalizzabile, tranne nel caso in cui il soluto sia un gas: in questo caso, la solubilità diminuisce sempre all’aumentare della temperatura. Tale comportamento ha anche importanti risvolti ambientali: quando scarichi industriali caldi si riversano nelle acque dei fiumi, il conseguente aumento di temperatura ne impoverisce il contenuto di ossigeno, con ricadute gravi sulla fauna acquatica.
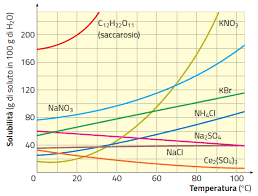
Nel caso in cui il soluto sia liquido o solido, non è possibile generalizzare il comportamento. In genere, la solubilità aumenta con l’aumentare della temperatura, ma in alcuni casi l’andamento è opposto, come nel caso del solfato di cerio, Ce2(SO4)3, in acqua.
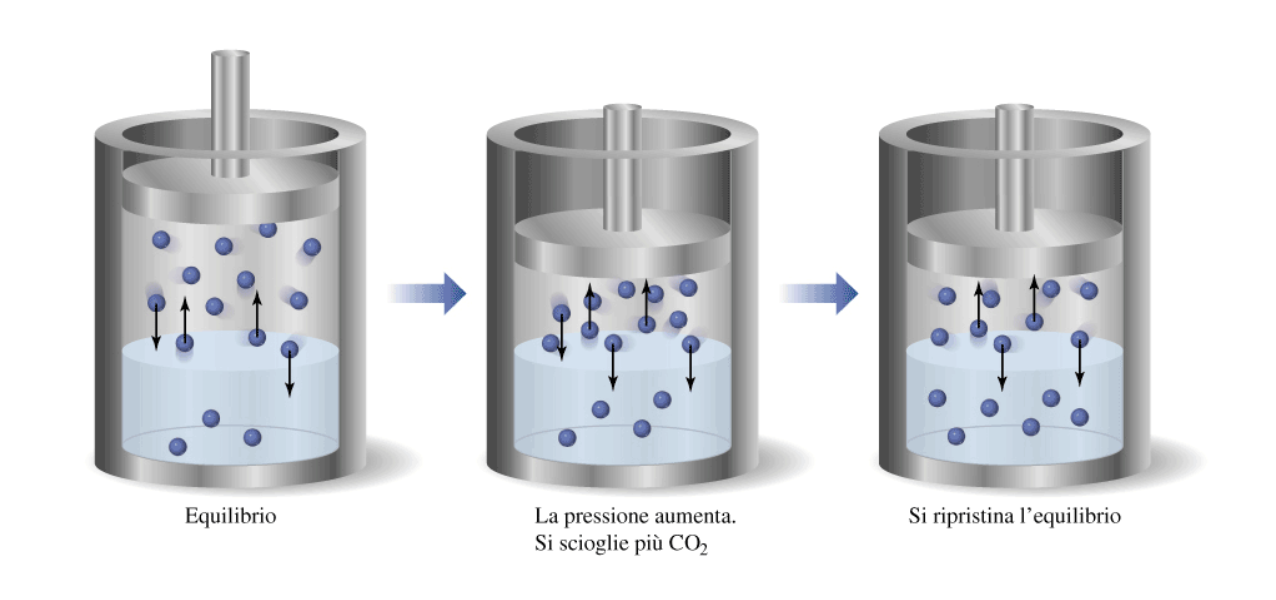
11. La solubilità dipende dalla pressione
La solubilità dipende apprezzabilmente dalla pressione solo nel caso in cui il soluto sia un gas. In questo caso, la solubilità aumenta sempre all’aumentare della pressione, secondo la legge di Henry:
\( C\left(\begin{array}{c}\frac{mol}{kg}\\ \end{array}\right)=k_H\left(\begin{array}{c}\frac{mol}{kg\cdot atm}\\ \end{array}\right)\cdot P(atm) \)
C è la concentrazione, P è la pressione e kH è una costante che dipende dalla natura del solvente e del soluto.
Questa dipendenza è una conseguenza del principio di Le Chatelier, perché un aumento di pressione su un sistema contenente un gas in equilibrio con una sua soluzione acquosa può essere minimizzato riducendo il numero di particelle in fase gassosa. Questo si traduce nel passaggio netto di molecole dalla fase gassosa a quella liquida, con conseguente aumento della concentrazione di quest’ultima.