Fissaidee 1
| Sito: | Federica Web Learning - LMS |
| Corso: | Scienze chimiche di base |
| Unit: | Fissaidee 1 |
| Stampato da: | Guest user |
| Data: | martedì, 26 agosto 2025, 21:25 |
1. Le reazioni di ossido-riduzione

Dopo aver esaminato le seguenti immagini dovremmo chiederci cosa accomuna le seguenti trasformazioni:l’esplosione dei fuochi d’artificio, la corrosione di un metallo, il funzionamento di una pila.
Esse costituiscono un’ampia famiglia di reazioni chimiche, che possono riguardare semplici processi come ad esempio la reazione di formazione di un sale binario fino a trasformazioni più complesse alla base della vita come, ad esempio, la fotosintesi e la respirazione.
2. Fenomeni di ossidazione e riduzione
Le ossido-riduzioni sono reazioni chimiche in cui avviene un trasferimento di elettroni tra almeno una coppia di atomi. Gli atomi donatori di elettroni si ossidano e vengono definiti gli agenti riducenti, mentre quelli accettori di elettroni si riducono e vengono definiti gli agenti ossidanti.
- Ossidazione → Cessione di elettroni
- Riduzione → Acquisto di elettroni

Le proprietà ossidanti o riducenti di una specie allo stato elementare sono riconducibili alla posizione che quest’ultimo occupa nella tavola periodica e, quindi, alle sue proprietà metalliche o non metalliche. I metalli caratterizzati da bassi valori dell’elettronegatività sono prevalentemente agenti riducenti, mentre i non metalli caratterizzati da alti valori dell’elettronegatività sono agenti ossidanti.
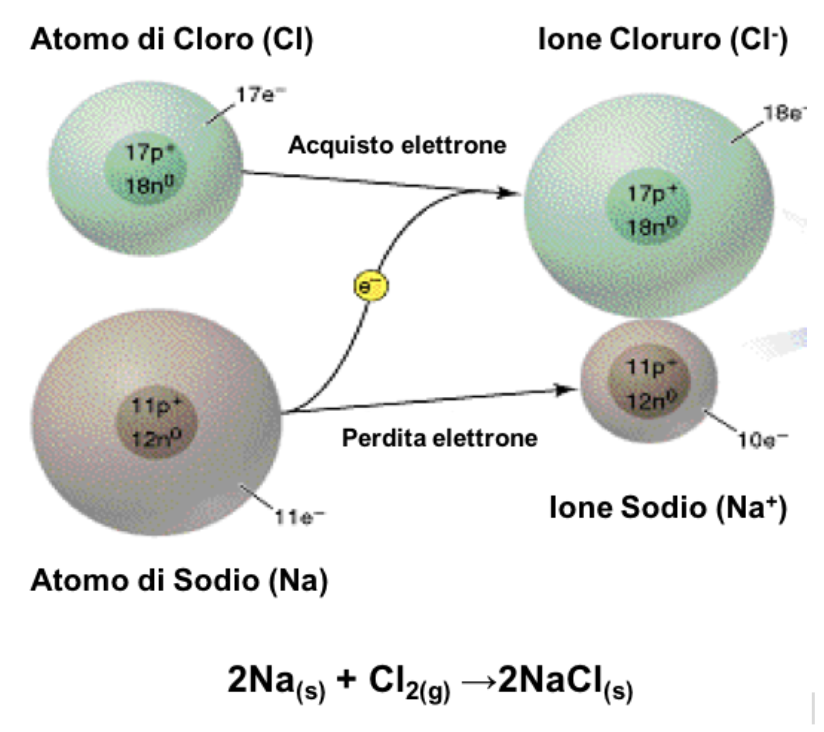
Nell’esempio riportato, il sodio, elemento metallico appartenente al I gruppo della tavola periodica, si ossida cedendo il proprio elettrone al cloro, elemento non metallico appartenente al VII gruppo della tavola periodica, il quale si riduce.
3. Numero di Ossidazione
Al fine di poter identificare facilmente in una reazione di ossido-riduzione la specie chimica che si ossida e quella che si riduce è necessario introdurre il concetto di numero di ossidazione e le regole che ci permettono di attribuirlo ad ogni atomo che fa parte di una specie poliatomica.
Il numero di ossidazione (n.ox.) di un atomo in una specie poliatomica è la carica elettrica formale che gli si può attribuire assegnando gli elettroni di legame all’atomo dell’elemento più elettronegativo.
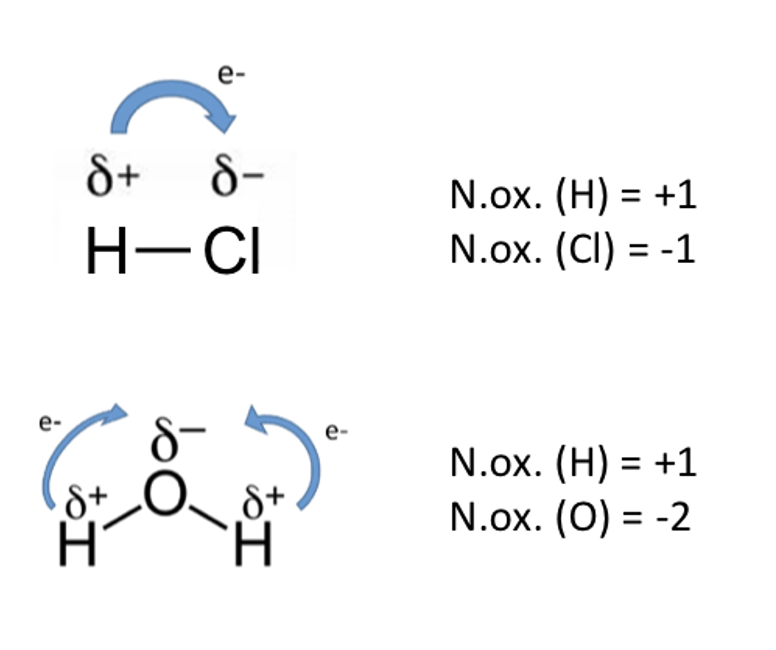
Nel caso dei composti ionici binari la carica formale diviene una carica elettrica reale:
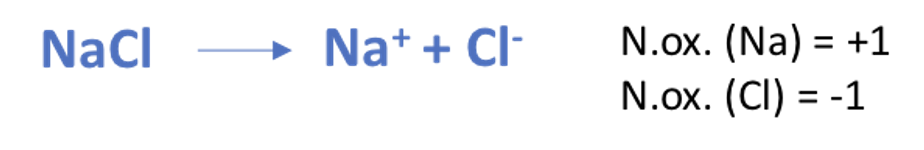
Nel caso del cloruro di sodio i numeri di ossidazione di Na+ e Cl- coincidono infatti con la carica netta degli ioni presenti nel composto ionico.
4. Esempi di attribuzione dei numeri di ossidazione
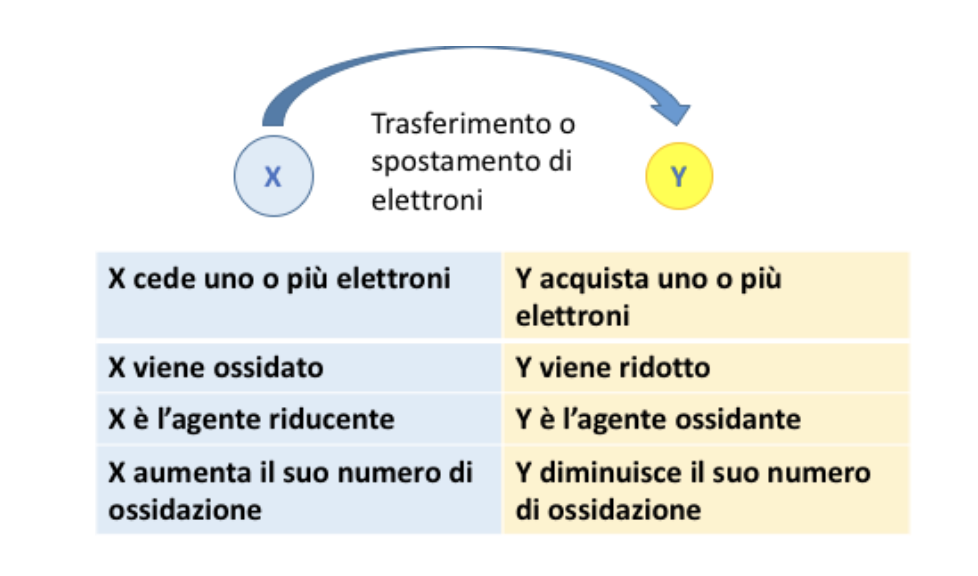
Gli atomi che vengono coinvolti nello scambio elettronico, cioè quelli che si ossidano e che quindi perdono elettroni e quelli che si riducono e che quindi acquistano elettroni, devono necessariamente cambiare il proprio numero di ossidazione.
L’atomo che perde elettroni aumenta il proprio numero di ossidazione di un numero di unità pari al numero di elettroni ceduti. Mentre l’atomo che acquista elettroni diminuisce il numero di ossidazione di un numero di unità pari al numero di elettroni acquistati.
I numeri di ossidazione di due o più specie cambiano:
- Se un atomo acquista n elettroni il suo numero di ossidazione diminuisce di n unità;
- Se un atomo cede n elettroni il suo numero di ossidazione aumenta di n unità.
5. Attribuzione del Numero di Ossidazione
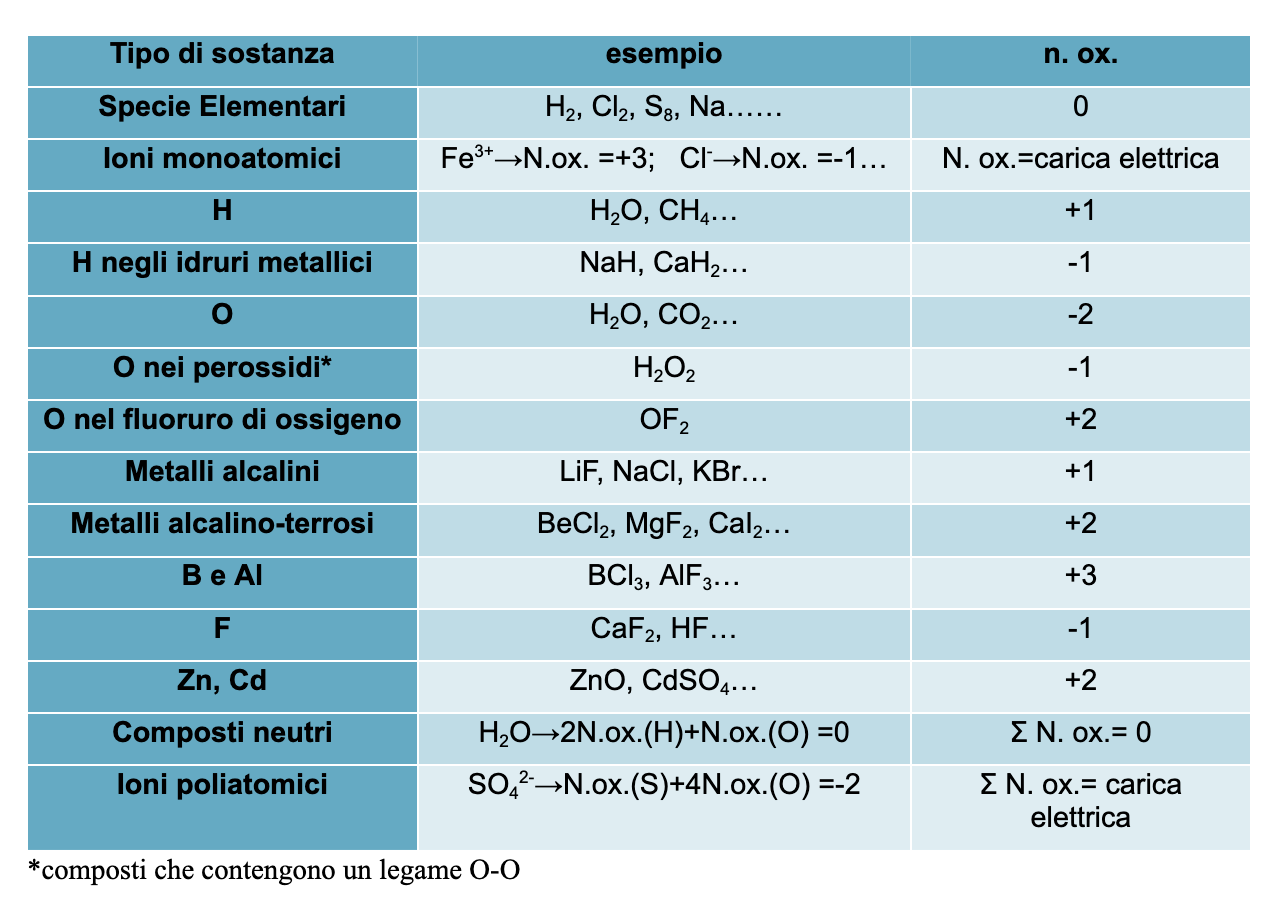
L’attribuzione dei numeri di ossidazione degli atomi (facenti parte di una determinata specie poliatomica) può essere fatta in base alla conoscenza dei valori di elettronegatività degli atomi, tra cui si è instaurato il legame chimico, ma ciò non risulterebbe molto agevole, mentre invece il processo risulta molto più semplice seguendo le regole esposte di seguito:
6. Esempi di attribuzione dei numeri di ossidazione
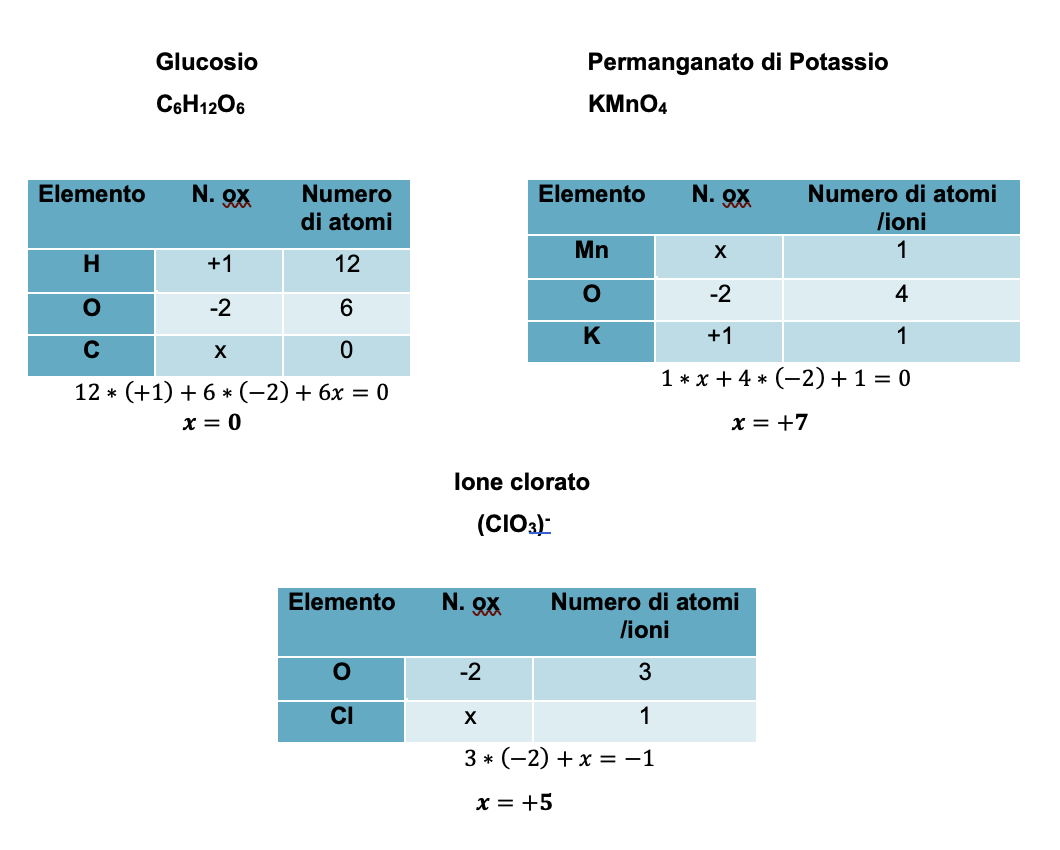
Esaminiamo tre esempi in cui, applicando le regole riportate nella precedente slide, riusciamo ad attribuire i numeri di ossidazione di tutti gli atomi appartenenti alle tre specie poliatomiche.
Nei primi due casi facciamo riferimento a composti (glucosio e permanganato di potassio), mentre nel terzo caso facciamo riferimento ad un anione poliatomico (ione clorato).