Fissaidee 2
| Site: | Federica Web Learning - LMS |
| Course: | Scienze chimiche di base |
| Unit: | Fissaidee 2 |
| Printed by: | Guest user |
| Date: | Tuesday, 26 August 2025, 9:25 PM |
Table of contents
- 1. Schema bilanciamento delle reazioni Red-Ox /1
- 2. Esempio bilanciamento reazioni Red-Ox /1
- 3. Esempio bilanciamento reazioni Red-Ox /2
- 4. Esempio bilanciamento reazioni Red-Ox /3
- 5. Schema bilanciamento delle reazioni Red-Ox /2
- 6. Esempio bilanciamento reazioni Red-Ox in ambiente acido /1
- 7. Esempio bilanciamento reazioni Red-Ox in ambiente acido /2
- 8. Esempio bilanciamento reazioni Red-Ox in ambiente basico /1
- 9. Esempio bilanciamento reazioni Red-Ox in ambiente basico
1. Schema bilanciamento delle reazioni Red-Ox /1
- Step 1. Assegnare i numeri di ossidazione a tutti atomi;
- Step 2. Identificare, in base ai N. ox. la specie che si ossida e quella che si riduce;
- Step 3. Calcolare il numero di elettroni ceduti nell’ossidazione e il numero di elettroni acquistati nella riduzione in base alla variazione dei numeri di ossidazione;
- Step 4. Imporre la conservazione del numero di elettroni. In altre parole assegnare opportunamente i coefficienti stechiometrici alle specie che si ossidano e si riducono in modo tale che sia verificato il PRINCIPIO di CONSERVAZIONE DEGLI ELETTRONI;
- Step 5. Completare il bilanciamento con le regole del metodo a vista.
2. Esempio bilanciamento reazioni Red-Ox /1
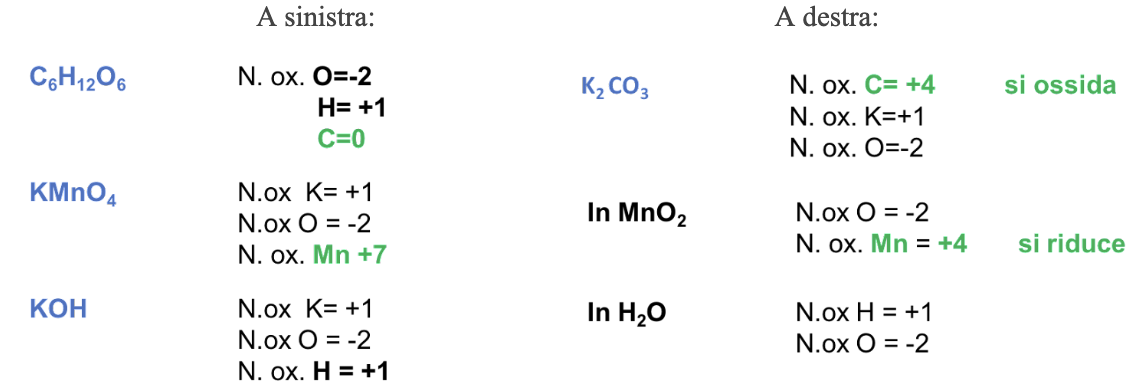
Esempio: C6H12O6 (s) + KMnO4 (s) + KOH (s) → K2CO3 (s) + MnO2 (s) + H2O (l)
Step 1. Assegnare i numeri di ossidazione a tutti gli elementi
Step 2. Identificare, in base ai numeri di ossidazione la specie che si ossida e quella che si riduce
3. Esempio bilanciamento reazioni Red-Ox /2
Step 3. Calcolare il numero di elettroni ceduti nell’ossidazione e il numero di elettroni acquistati nella riduzione in base alla variazione dei numeri di ossidazione
ESEMPIO:
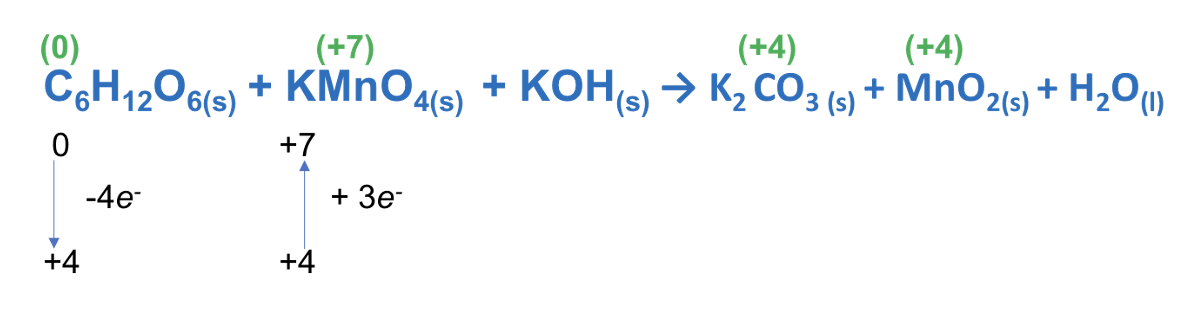
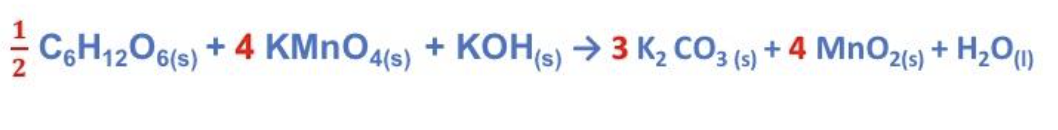
Step 4. Imporre la conservazione del numero di elettroni. Stabilire il rapporto tra gli atomi che si ossidano e quelli che si riducono in modo che il numero di elettroni ceduti coincida con quelli acquistati.
Nello specifico caso:

Assegnare opportunamente i coefficienti stechiometrici per rispettare tale rapporto. Nel caso del carbonio, che è presente nel glucosio con il pedice 6, per avere 3 atomi di carbonio è necessario fissare il coefficiente stechiometrico pari a ½.
4. Esempio bilanciamento reazioni Red-Ox /3
Step 5. Completare il bilanciamento con le regole del metodo a vista.
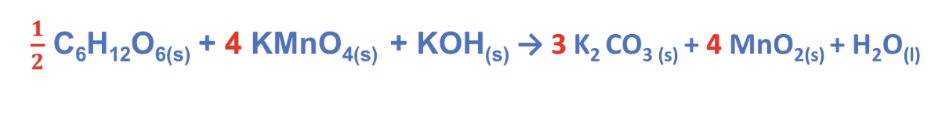
Bilanciamo a vista K:

Bilanciamo a vista H:
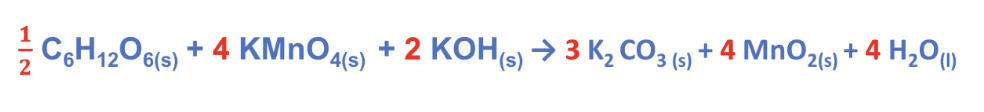
Verifichiamo su O: Atomi di O a sinistra = 21
Atomi di O a destra = 21
Reazione bilanciata!
5. Schema bilanciamento delle reazioni Red-Ox /2
- Step 1. Se necessario scrivere le reazioni in forma ionica, eliminare gli ioni spettatori e assegnare i numeri di ossidazione a tutti atomi;
- Step 2. Identificare, in base ai N. ox. la specie che si ossida e quella che si riduce;
- Step 3. Calcolare il numero di elettroni ceduti nell’ossidazione e il numero di elettroni acquistati nella riduzione in base alla variazione dei numeri di ossidazione;
- Step 4. Imporre la conservazione del numero di elettroni. In altre parole assegnare opportunamente i coefficienti stechiometrici alle specie che si ossidano e si riducono in modo tale che sia verificato il PRINCIPIO di CONSERVAZIONE DEGLI ELETTRONI;
- Step 5. Bilanciare le cariche tenendo conto dell’ambiente (ambiente acido: aggiungere, se necessario, tanti ioni H+ o tra i reagenti o tra i prodotti in modo tale che la somma algebrica delle cariche tra i reagenti coincida con quella tra i prodotti. Analogo discorso per l’ambiente basico, in cui però vanno aggiunti ioni OH-);
- Step 6. Completare il bilanciamento con le regole del metodo a vista ed aggiungere, se necessario, molecole di acqua dalla parte dei reagenti o dei prodotti per bilanciare l’idrogeno e l’ossigeno.
6. Esempio bilanciamento reazioni Red-Ox in ambiente acido /1
Reazione in ambiente acido:
Ambiente Acido: presenza di ioni H+
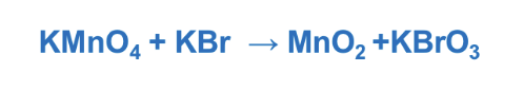
Step 1/2. Riscrivere la reazione in forma ionica eliminando gli ioni spettatori e assegnare i numeri di ossidazione ali elementi dei reagenti e dei prodotti. Identificare gli elementi che si ossidano e quelli che si riducono.
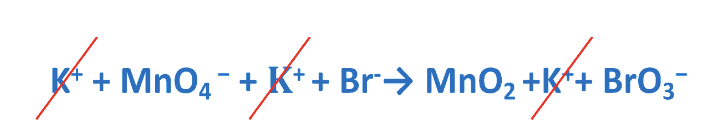

Step 3. Calcolare il numero di elettroni ceduti nell’ossidazione e il numero di elettroni acquistati nella riduzione.
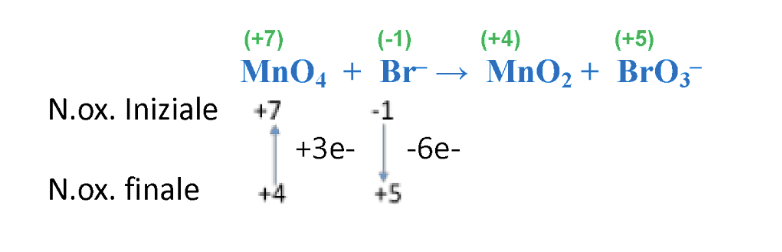
Step 4. Imporre il rispetto del principio di conservazione degli elettroni (il numero degli elettroni ceduti deve risultare pari al numero di elettroni acquistati).
Nel caso specifico il rapporto tra gli atomi di Br e Mn deve essere pari a:

Modificare i coefficienti stechiometrici in modo tale da rispettare questo rapporto:
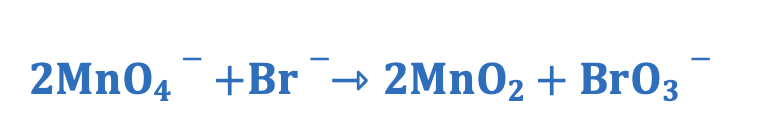
7. Esempio bilanciamento reazioni Red-Ox in ambiente acido /2
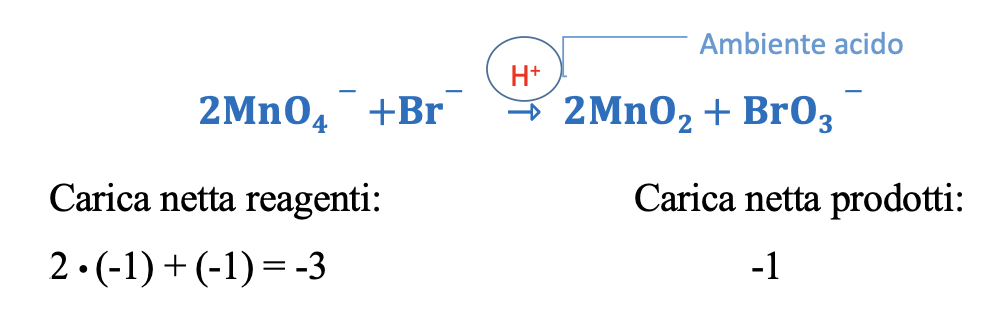
Per ottenere il bilanciamento delle cariche, in questo caso bisogna neutralizzare 2 cariche negative a sinistra (reagenti), quindi aggiungere 2 ioni H+.
![]()
Per bilanciare gli atomi di H e O si aggiunge H2O dove richiesto. In questo caso H2O si aggiunge tra i prodotti, in quanto c’è mancanza di atomi di H e O.
![]()
8. Esempio bilanciamento reazioni Red-Ox in ambiente basico /1
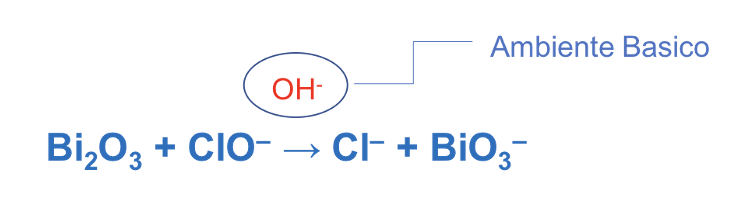
Step 1/2. Assegnare i numeri di ossidazione agli atomi presenti nei reagenti e nei prodotti. Identificare gli atomi che si ossidano e quelli che si riducono.

Step 3. Calcolare il numero di elettroni ceduti nell’ossidazione e il numero di elettroni acquistati nella riduzione.
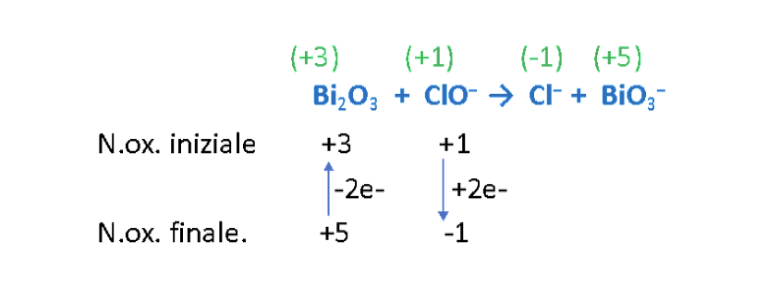
Step 4. Imporre il rispetto del principio di conservazione degli elettroni. A tal proposito, il rapporto tra gli atomi di Bi e Cl deve essere pari a:

Modifichiamo i coefficienti stechiometrici in modo tale da rispettare questo rapporto.
![]()
9. Esempio bilanciamento reazioni Red-Ox in ambiente basico
Step 5: Bilanciamento delle cariche elettriche
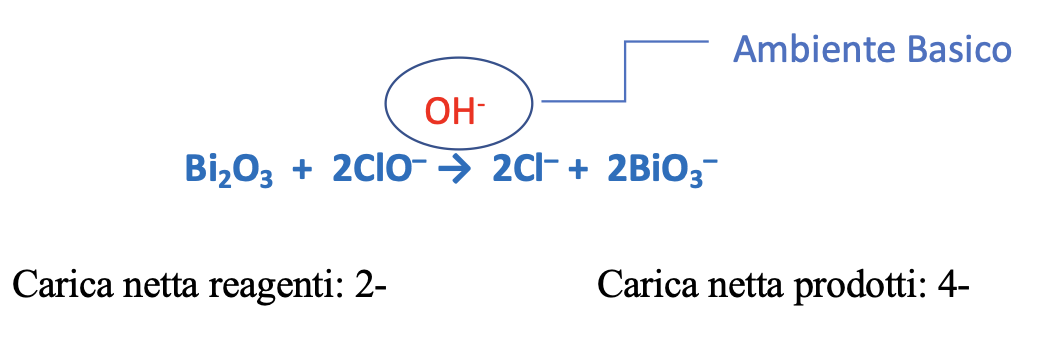
Per ottenere il bilanciamento delle cariche, in questo caso bisogna incrementare di 2 unità le cariche negative a sinistra (reagenti), quindi aggiungere 2 ioni OH-
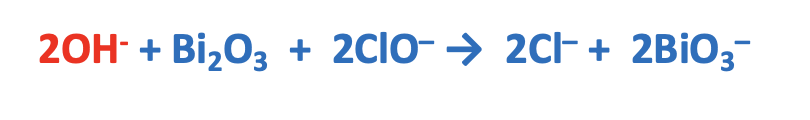
Per bilanciare gli atomi di H e O si aggiunge H2O, dove richiesto. In questo caso H2O si aggiunge tra i prodotti, in quanto c’è mancanza di atomi di H e O.
![]()