Fissaidee 1
| Sito: | Federica Web Learning - LMS |
| Corso: | Scienze chimiche di base |
| Unit: | Fissaidee 1 |
| Stampato da: | Utente ospite |
| Data: | martedì, 26 agosto 2025, 21:26 |
Indice Unit
- 1. Cosa sono gli acidi e le basi?
- 2. Caratteristiche acido/base di sostanze comunemente utilizzate nel quotidiano
- 3. Posso riconoscere acidi o basi dal loro comportamento senza assaggiare?
- 4. Specie acide nel nostro quotidiano…
- 5. …e specie basiche
- 6. Gli acidi nell’ambiente: le piogge acide
- 7. Ma è possibile dare definizioni generali di acido e base?
- 8. Le reazioni acido-base /1
- 9. Le reazioni acido-base /2
- 10. Esempio di una reazione acido-base
1. Cosa sono gli acidi e le basi?
Il concetto di acido, nella vita comune, si perde nel passato lontano e da sempre lo abbiniamo ad un gusto (sapore aspro, acre) e, a volte, anche al carattere ‘spigoloso’ di una persona ma le definizioni chimiche di acido e base (il contrario dell’acido, specie con caratteristiche opposte all’acidità) sono state molte e molto più recenti fino ad arrivare (nel 1923) a quelle attualmente accettate e condivise dal mondo scientifico che dobbiamo a Brønsted e Lowry e a Lewis.
Questo ‘ritardo’ è abbastanza strano se pensiamo che quotidianamente non possiamo fare a meno dal venire a contatto con sostanze acide e basiche sia dentro che fuori dal nostro corpo, sia nei cibi e nelle bevande che nell’ambiente che ci circonda come il regno vegetale e gli eventi metereologici.
Pensate che per secoli gli scienziati hanno usato definizioni empiriche, determinando il carattere acido o basico delle sostanze assaggiandole: se il sapore era acre allora era una sostanza acida, nel caso fosse stato saponoso veniva identificata come basica!
Anche i termini hanno la loro storia ed origine più o meno antica. Il termine acido deriva dal latino acere, acro, mentre base si ritiene coniato nel XVIII secolo dal chimico francese Guillaume-François Rouelle per indicare le specie che, unite ad un acido, costituissero la base (appunto!) per la formazione di un sale.

Le basi vengono però chiamate anche alcali parola di origine molto più antica che viene dall’arabo al qali (cenere) e si pensa sia dovuta al fatto che dalle ceneri di diversi legni si ottenessero soda e potassa (basi!).
2. Caratteristiche acido/base di sostanze comunemente utilizzate nel quotidiano
Ma quali sono le sostanze acide e basiche nel nostro quotidiano? Sono proprio così tante e così importanti?
❗❗ Assolutamente sì!
Sono dentro di noi, nei cibi (che sono quasi esclusivamente leggermente acidi, qualche esempio è riportato qui sotto), nelle bevande, in alcune strumentazioni o oggetti, nei detergenti, saponi, cosmetici, soluzioni di vario genere che usiamo nel nostro quotidiano, nei medicinali e persino negli eventi atmosferici! Insomma, ovunque!
Vedremo in questa lezione che l’acidità e la basicità si possono trattare quantitativamente e costruire una scala (di pH) che va da massima acidità (0) a massima basicità (14) passando per la neutralità (7) dell’acqua pura.

Qui sopra sono riportati alcuni esempi inserendoli in questa scala ed approssimandoli al valore intero più ragionevole.
3. Posso riconoscere acidi o basi dal loro comportamento senza assaggiare?
Tutti sappiamo che gli acidi abbastanza concentrati sono corrosivi, posso usare questa caratteristica per distinguerli dalle basi?
❗❗ NO non è possibile perché il comportamento degli acidi e delle basi agli estremi della scala (0-1 e 13-14, cioè quando sono concentrati) è del tutto analogo! Entrambi sono corrosivi!

La segnaletica di pericolo di sostanze corrosive evidenziata in figura sia per l’acido cloridrico concentrato – normalmente noto come acido muriatico –, che per l’ipoclorito di sodio concentrato – normalmente noto come candeggina o varecchina –, significa:
Pericolo: Prodotti chimici che per contatto distruggono sia tessuti viventi che attrezzature di laboratorio.
Precauzioni: Non respirare i vapori ed evitare il contatto con la pelle, occhi ed indumenti. Utilizzare idonee apparecchiature di laboratorio resistenti a tali agenti.
Allora forse possiamo distinguerli dalla loro capacità di aiutare a sciogliere solidi poco solubili in acqua! Se aiuta a sciogliere è un acido altrimenti è una base, giusto??
❗❗ SBAGLIATO, alcuni solidi non si sciolgono in acqua ma lo fanno se si aggiunge un acido, altri hanno lo stesso comportamento ma solo se si aggiunge una base!
Per esempio, il marmo (costituito dal carbonato di calcio CaCO3, è un sale molto poco solubile spesso usato come materiale nella costruzione (palazzi, chiese, piazze o monumenti!!!) viene sciolto lentamente dalle piogge acide (vedi dopo) MA l’idrogeno fosfato di calcio (o fosfato monoacido di calcio CaHPO4) che è un additivo alimentare presente anche in alcuni dentifrici, un solido bianco poco solubile, si scioglie molto di più sia acqua basica che in acqua acida.
4. Specie acide nel nostro quotidiano…
A parte i succhi gastrici (molto) acidi che ci permettono la digestione, moltissime sostanze sono caratterizzate da una più o meno forte acidità, per esempio, la Coca Cola (molto acida! quasi come i succhi gastrici e più dell’aceto) che presenta la stessa acidità del limone e il pomodoro, seppur meno acido dei primi due.
Ancora più interessante è la reattività che l’acidità di una sostanza comporta o induce quando viene mescolata/additivata con altri cibi o bevande. Facciamo un esempio che conosciamo…ma magari non fino in fondo!
Mangiare cibi freschi è la cosa giusta!…ma non sempre è possibile!
La conservazione dei cibi è dunque necessaria ma è resa difficile dalla proliferazione di batteri e funghi contaminanti o prodotti da reazioni chimiche, ad esempio di ossidazione che si sviluppano all’aria grazie a enzimi.
Uno dei modi per prevenire tali ossidazioni è disattivare gli enzimi che funzionano grazie alla loro complicata struttura che viene modificata (‘denaturata’) dagli acidi, dunque: l’aggiunta di acidi disattiva gli enzimi e senza la loro attività si bloccano processi che causano la degradazione del cibo!
Quando questo non basta si usano altre sostanze acide (altri additivi) il cui contenuto deve essere specificato nelle etichette e controllato in quantità.
Quali acidi si usano?
L’aceto nei sottaceti, il limone per non fare imbrunire mele o carciofi e la vitamina C (acido L ascorbico, va detto per completezza che questo acido ha anche un secondo effetto antiossidante indipendente dalla natura acida) che è un tipico additivo per la conservazione!
Quando questo non basta si usano altre sostanze acide (altri additivi) il cui contenuto deve essere specificato nelle etichette e controllato in quantità.
5. …e specie basiche
Nel nostro corpo…al contrario dello stomaco, i succhi pancreatici sono basici e quando questo organo è sano lavora in condizioni basiche (pH tra 7,8 e 8).
Nella storia... la potassa (carbonato di potassio, K2CO3) è una polvere bianca solubile in acqua, ricavata dalla cenere lignea e vegetale che in passato veniva utilizzata soprattutto nella produzione dei saponi.
Per farlo si cuocevano miscele di oli vegetali o grassi animali e potassa, facendo avvenire una reazione chimica (saponificazione) che trasforma gli acidi grassi, in presenza di una base (potassa), in sapone (sali di acidi grassi). Sono state trovate testimonianze di questo processo già dal 2500 a.C.
Nel quotidiano... forse non lo sapete ma molti di voi hanno fatto personalmente avvenire una reazione di saponificazione e proprio in casa vostra!

6. Gli acidi nell’ambiente: le piogge acide
Le piogge acide sono piogge (o neve o grandine) che contengono degli acidi, in particolare, H2SO4 e HNO3 che si formano da inquinanti aeriformi: il diossido di zolfo (SO2) di origine antropica (combustione di carbone e petrolio e derivati) per circa il 60% e il diossido di azoto (NO2), di origine antropica (motori a scoppio e centrali termoelettriche) per una percentuale variabile fino al 50%. L’ossigeno dell’atmosfera li ossida e poi, per reazione con l’acqua presente nell’atmosfera (umidità), si formano gli acidi.
La formazione di tali inquinanti causata dalle attività umane si concentra nelle zone urbane più industrializzate ma essendo aeriformi, trasportati dal vento, possono percorrere centinaia di chilometri prima di venire convertiti in piogge acide.
Le piogge sono acide se il loro pH < 5,6 (valore relativo alla scala 0-14 vista prima, vedere unit 5.2) e non sono dannose per l’uomo direttamente: bagnarsi o utilizzare queste acque per uso domestico (per esempio per lavarsi) non causa effetti nocivi per il nostro corpo.
Hanno, invece, effetti estremamente negativi per l’ambiente, specialmente per le acque (abbassamento del pH delle acque, molti laghi stanno diventando deserti biologici in USA, Canada e nord Europa) e le foreste (impoverimento del suolo, interferisce con la nutrizione delle piante).
Un effetto immediatamente evidente a tutti è quello che hanno sui nostri monumenti ed edifici di marmo che vengono danneggiati (sciolti, corrosi dall’acqua acida mentre non sono intaccati dall’acqua pura!).
Si possono ridurre le emissioni degli inquinanti aeriformi di origine antropica ma ancora non si fa abbastanza: per ridurre l’emissione di SO2 è necessario eliminare lo zolfo dal carbone e dal petrolio prima di usarli come combustibili (possibile, almeno in parte, ma non semplicissimo) mentre per abbattere le emissioni di NO2 si usano le cosiddette marmitte catalitiche.

7. Ma è possibile dare definizioni generali di acido e base?
Definizione di Arrhenius (1884)
- Acido: Specie chimica che, dissociandosi in soluzione, fornisce ioni H+.
- Base: Specie chimica che, dissociandosi in soluzione, fornisce ioni OH-
Non abbastanza generale, non tiene conto che: a) non tutte le basi presentano il gruppo OH- nella loro struttura (NH3, per esempio); b) il comportamento di acidi e basi dipende dal solvente e dalle altre specie attive in soluzione.
Teoria di Brønsted e Lowry (1923)
- Acido: Specie chimica (molecolare o ionica) capace di cedere uno ione H+(donatore di protoni).
- Base: Specie chimica (molecolare o ionica) capace di legarsi ad uno ione H+ (accettore di protoni).
Definizione più generale e più utilizzata in chimica inorganica:
- implica il concetto di coppia acido/base coniugata (vedi dopo);
- il comportamento acido richiede la presenza di una base in soluzione (e viceversa).
Teoria di Lewis (1923)
- Acido: Specie chimica (molecolare o ionica) capace di accettare un doppietto elettronico (accettore).
- Base: Specie chimica (molecolare o ionica) capace di donare un doppietto elettronico (donatore).
Definizione ancora più generale ed in assoluto più usata in chimica organica, è semplice e largamente applicabile.
8. Le reazioni acido-base /1
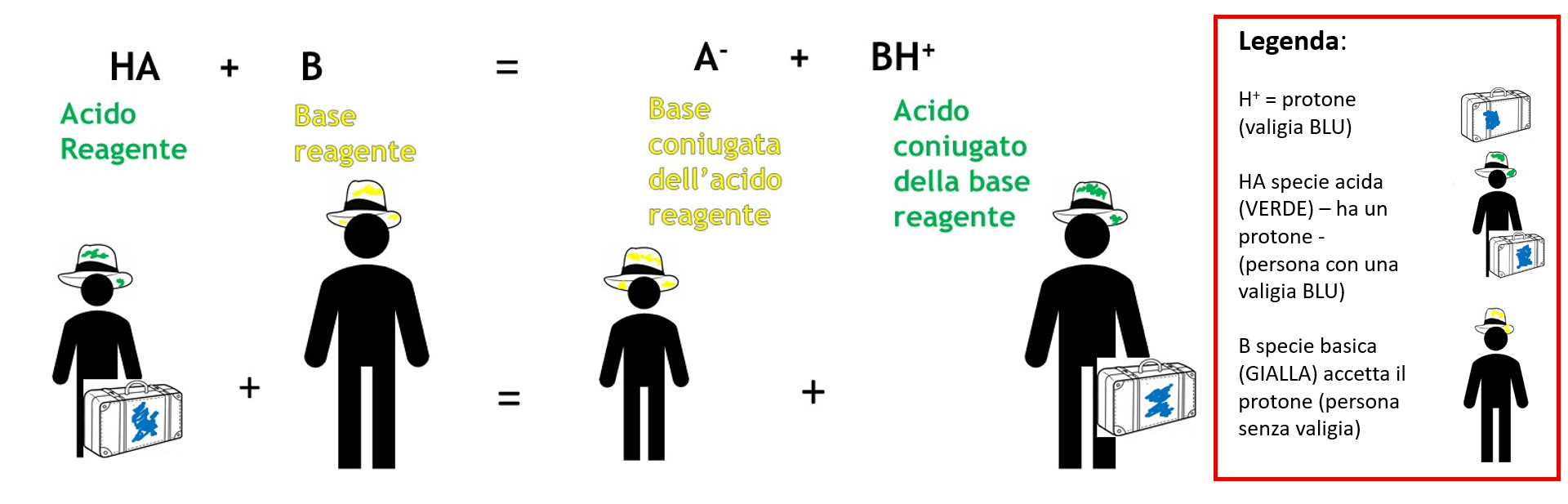
Nelle reazioni di ossidoriduzione (unit 6.1) vengono scambiati elettroni, in maniera analoga nelle reazioni acido-base vengono scambiati protoni cioè ioni H+ (teoria di Brønsted e Lowry). Come un riducente ha bisogno di un ossidante per reagire un acido non può reagire con un altro acido o una base con un’altra base ma gli acidi reagiscono con le basi (e viceversa).
Questo tipo di reazione è molto semplice e si basa sullo scambio di un protone (H+): l’acido cede un protone alla base che lo prende. Potete vedere il protone come una valigia che si passano due amici, chi ha la valigia è acido chi è senza valigia è basico, quando si passano la valigia la loro caratteristica si scambia.
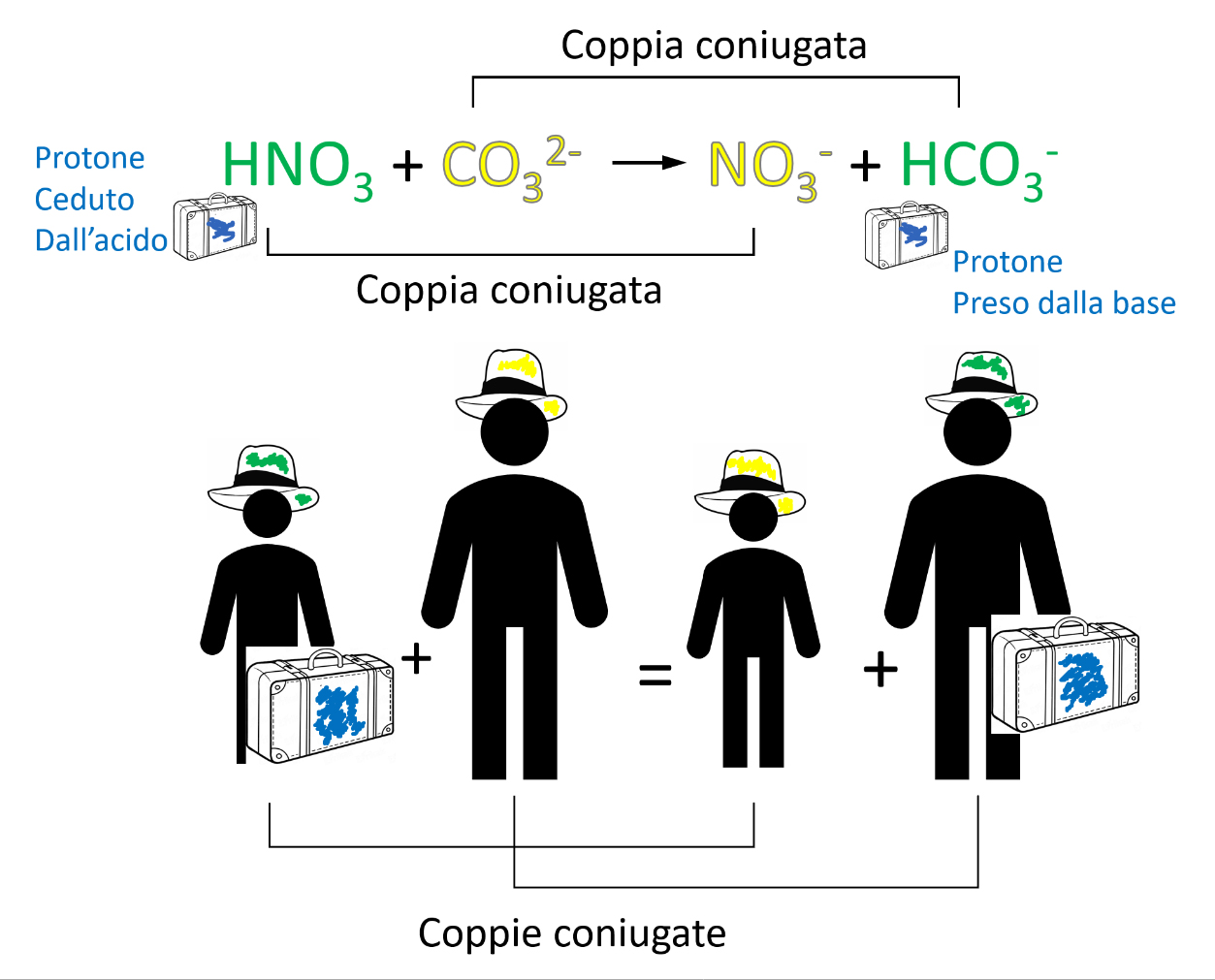
9. Le reazioni acido-base /2
Cedendo il protone, un acido si trasforma in una sostanza che è potenzialmente capace di riacquistare il protone, cioè in una base; prendendo un protone in più una base si trasforma in un acido cioè in una specie in grado di cedere un protone. La conseguenza diretta e fondamentale è che i reagenti scambiandosi un protone danno come prodotti nuovamente un acido ed una base come evidenziato nella schematizzazione seguente:
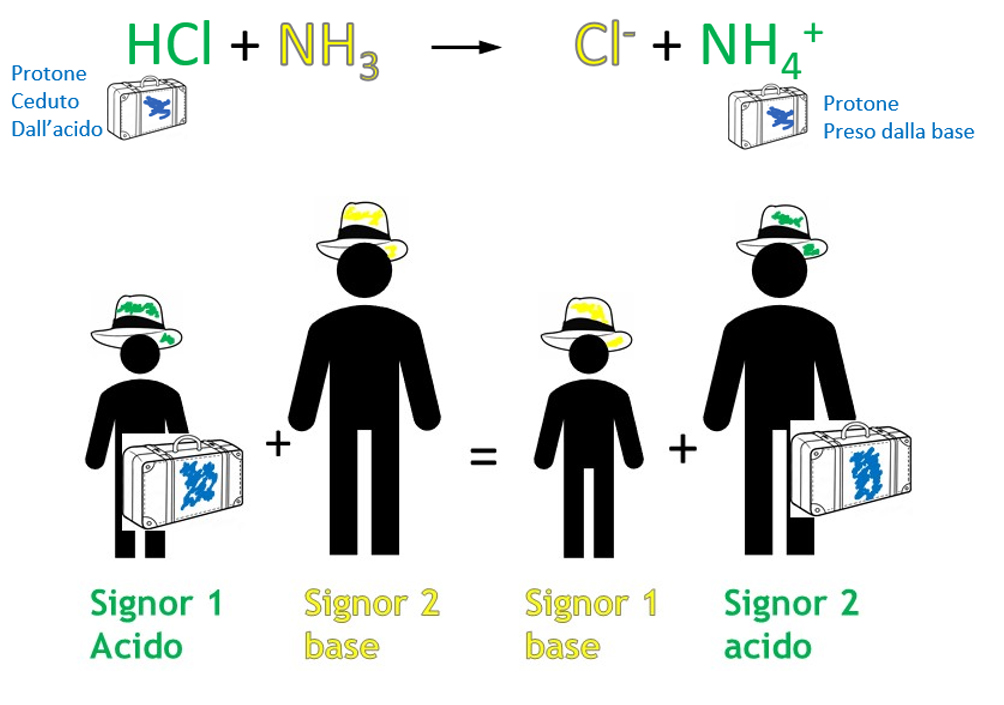
Di conseguenza sarà importante considerare ogni acido (ed ogni base) non come un singolo ma come una coppia di due specie con proprietà opposte dal punto di vista acido-base che differiscono tra loro per la presenza di un protone.
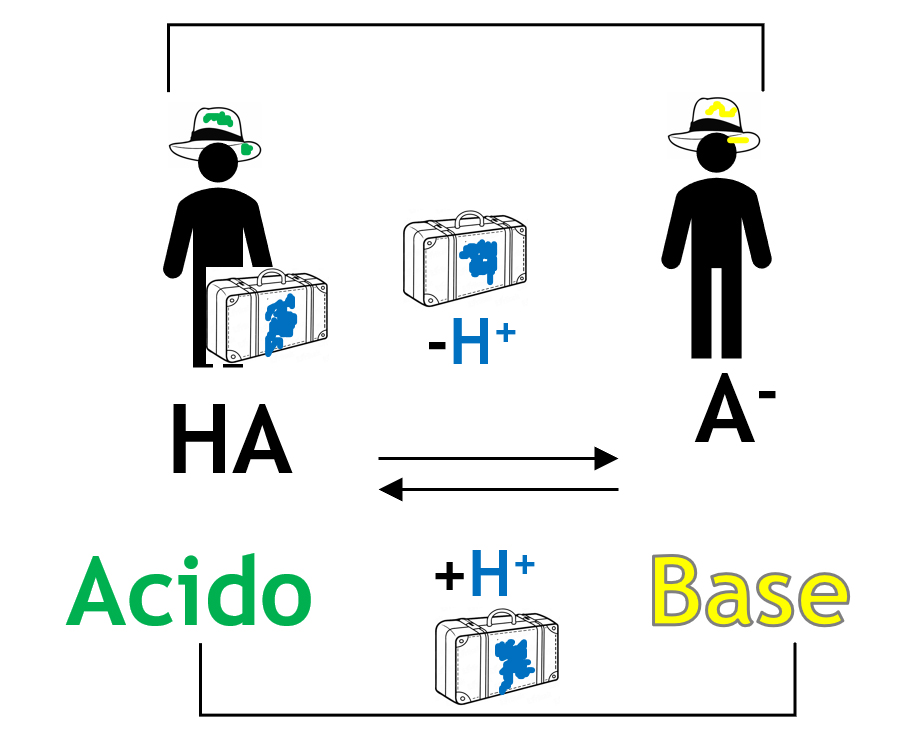
Ogni coppia viene detta: coppia di ACIDO E BASE CONIUGATI.
Esempi di coppie acido e base coniugati

10. Esempio di una reazione acido-base
Prendiamo in considerazione la reazione acido-base responsabile del danneggiamento dei monumenti e edifici di marmo corrosi dall’acqua acida (acido nitrico HNO3 è uno dei due acidi che si formano in atmosfera e rendono acide le pioggie).
Nella figura qui sotto si mettono bene in evidenza (anche aiutandosi con la schematizzazione) lo scambio del protone (H+) alla base delle reazioni acido-base, le coppie coniugate coinvolte, le proprietà acide o basiche dei reagenti e dei prodotti.