Fissaidee 2
| Site: | Federica Web Learning - LMS |
| Course: | Scienze chimiche di base |
| Unit: | Fissaidee 2 |
| Printed by: | Guest user |
| Date: | Tuesday, 26 August 2025, 9:25 PM |
Table of contents
- 1. Proprietà acido-base dell’acqua
- 2. La reazione dell’acqua con sé stessa /1
- 3. La reazione dell’acqua con sé stessa /2
- 4. La reazione dell’acqua con sé stessa /3
- 5. Soluzioni acide, basiche e neutre
- 6. Definizione di pH
- 7. Definizione di pOH
- 8. Forza di acidi e basi /1
- 9. Forza di acidi e basi /2
- 10. Calcoliamo il pH nei due casi per soluzioni alla stessa concentrazione
1. Proprietà acido-base dell’acqua
Visto che le reazioni acido-base più comuni sono in acqua (alimentazione, biologia, medicina e ambiente) è importante capire il comportamento dell’acqua pura in termini di reattività acido-base.
La prima domanda: l’acqua ha degli atomi di idrogeno, può cederne uno come protone (può cedere una sua valigia)?
Seconda domanda: l’acqua presenta degli atomi di ossigeno con coppie di elettroni solitarie che possono essere condivise per legare un protone (H+ non ha elettroni esterni), può accettare dunque un protone (può prendere la valigia?)?
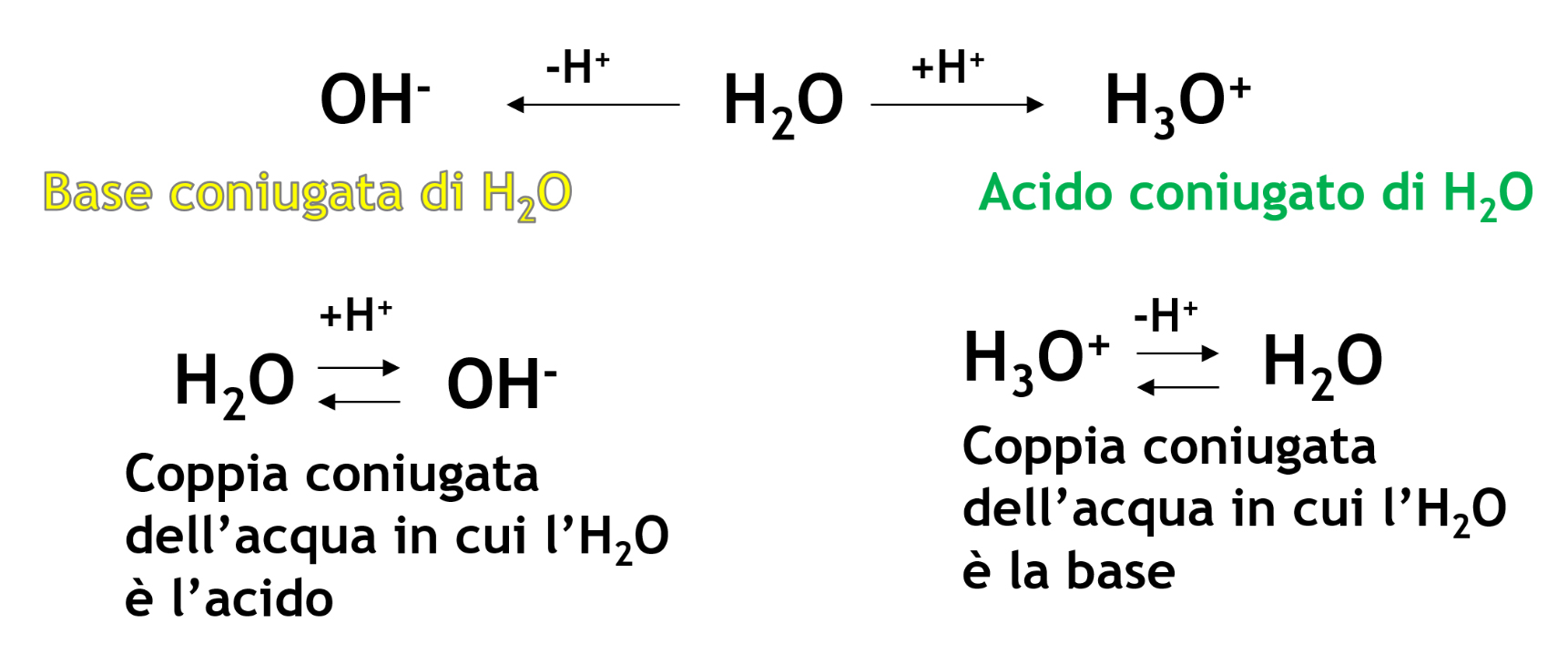
La risposta è sì per entrambe le domande, dunque, la specie chimica H2O può sia cedere che prendere un protone: si può comportare sia da acido che da base.
Le sostanze che si possono comportare sia da acido che da base si dicono anfiprotiche e formano due coppie acido-base coniugata.
2. La reazione dell’acqua con sé stessa /1
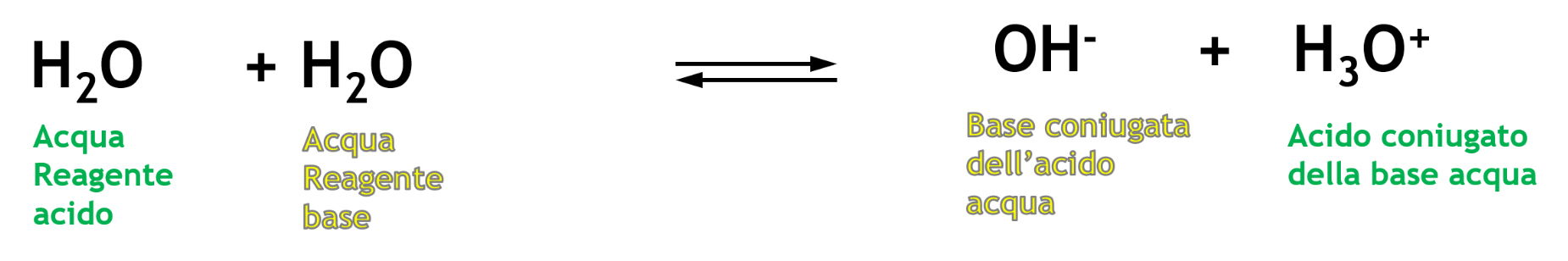
L’acqua è dunque un acido che può reagire con un’altra molecola di acqua che si comporta da base e scambiandosi un protone (scambiandosi la valigia), si ottengono le due specie coniugate dell’acqua: OH- e H3O+ .
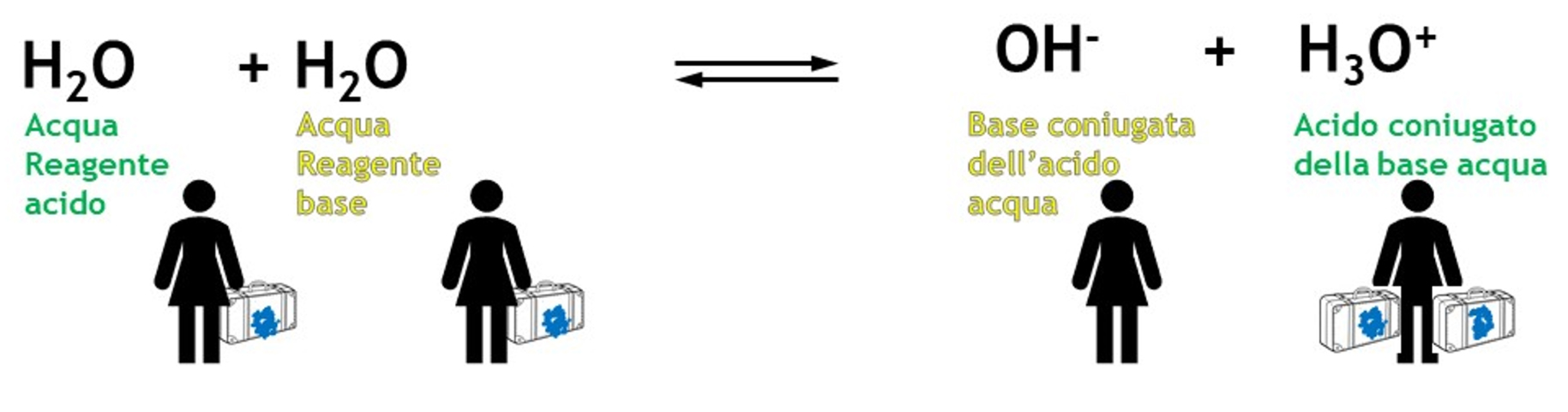
La reazione dell’acqua con sé stessa si chiama autoprotolisi dell’acqua (detta anche autoionizzazione perché per reazione tra due molecole neutre di acqua si ottengono due ioni).
Come abbiamo visto le reazioni chimiche possono essere complete o di equilibrio, la prossima domanda dunque è:
la reazione di autoprotolisi dell’acqua a quale delle due categorie appartiene?
Anche senza conoscere nulla di chimica, sappiamo tutti che possiamo bere un bicchiere d’acqua o nuotare nel mare, dunque la reazione non può essere completa altrimenti tutte le molecole di acqua reagirebbero tra loro e non ci sarebbero più molecole di H2O sulla Terra.La reazione di autoprotolisi dell’acqua sarà dunque un equilibrio e sarà caratterizzata da una sua costante di equilibrio che, in realtà, ha un valore molto basso! Dunque, solo una percentuale molto piccola di molecole di acqua, in acqua pura, reagiscono tra loro.
3. La reazione dell’acqua con sé stessa /2
La costante di equilibrio della reazione di autoprotolisi dell’acqua Kc è:
\( K_c=\frac{[OH^{-}][H_{3}O^{
+}]}{[H_2O]^{2}} \)
e si vede come, con un semplice riarrangiamento matematico,
da essa si possa ottenere una nuova costante talmente importante che le è stato dato uno specifico nome: Kw dove il pedice w indica la parola water, cioè acqua in inglese.
\( K_W=K_c[H_2O]^2= [OH^-][H_3O^+]=1.00\times10^{-14}M^2 \)
Dal momento che il valore della costante è molto piccolo, la quantità di acqua che reagisce è pochissima e si può considerare la concentrazione dell’acqua costante. Per questo è possibile inglobarla in una nuova costante che viene chiamata costante di autoprotolisi dell’acqua Kw.
Come tutte le costanti di equilibrio, anche Kc dell’autoprotolisi dell’acqua dipende dalla temperatura a cui la reazione viene fatta avvenire: a 25°C (temperatura standard, cioè di riferimento, per le soluzioni) il suo valore è tale per cui Kw risulta appunto 10-14 M2\( K_W=[OH^-][H_3O^+]=1.00×10^{-14}M^2 \)
Qualitativamente possiamo già capire come l’acqua sia poco attiva sia come acido che come base, possiamo dunque chiamarla debole in entrambe le sue attività, perché produce pochissimi ioni OH- e H3O+ per reazione di autoprotolisi.
A questo punto, sapendo il valore di Kw, possiamo calcolare quanti OH- e H3O+ produce esattamente per ogni litro di acqua!
4. La reazione dell’acqua con sé stessa /3
Facciamo il calcolo di quanti ioni OH- e H3O+ la reazione di autoprotolisi produce esattamente per ogni litro di acqua: sapendo il valore di Kw e che OH- e H3O+ si producono nella stessa quantità in acqua pura (ogni due molecole di H2O che reagiscono si produce uno ione OH- e uno ione H3O+), basta fare la radice quadrata!
\(
K_W=[OH^{-}][H_3O^+]=1.00×10^{-14} M^2 \)
\( [H_3O^+]=[OH^-]=\sqrt{K_W}=\sqrt{1.00×10^{-14}}= 1.00×10^{-7}M \)
Perché ci interessa questa quantità? Ci sono delle proprietà che noi conosciamo legate a questa quantità di H3O+ e OH- in acqua o in soluzioni acquose?
È importante fare questo calcolo?
Assolutamente sì, moltissimo! La nostra stessa vita dipende da questa quantità!
I nostri organi funzionano e le nostre funzioni vitali avvengono solo in presenza di una certa concentrazione di H3O+ e OH-, tale concentrazione può variare solo in intervalli molto piccoli per mantenere l’ottimale funzionalità.
Per esempio, la concentrazione di H3O+ nel sangue deve essere compresa tra 4,47 x 10-8 M e 3,55 x 10-8 M, notare quanto piccole siano queste concentrazioni e dunque quanto piccola sia la variabilità tollerata!
Ma cosa succede se la concentrazione di H3O+ supera il limite superiore? Questa condizione clinica anomala si chiama acidosi e, se lieve, causa sintomi non specifici come affaticamento, nausea e vomito ma, se acuta, causa problemi respiratori, mal di testa, stato confusionale e può portare al coma e, nei casi più gravi, alla morte.
Sì, sapere la quantità esatta di ioni H3O+ presenti in determinati ambienti è molto molto importante!
5. Soluzioni acide, basiche e neutre
Abbiamo visto che nell’acqua pura a 25 °C Kw = 1 x 10-14 M2 dunque:
\( [H_3O^+]=[OH^-]=\sqrt{K_W}=\sqrt{1.00×10^{-14}}= 1.00×10^{-7}M \)
Possiamo prendere questa situazione come quella di partenza, una situazione in cui non prevalgono né le proprietà acide né quelle basiche, la possiamo dunque definire situazione di neutralità!
In base a quanto detto, possiamo definire:
Acida qualsiasi soluzione in cui [H3O+] > [OH-]
Neutra qualsiasi soluzione in cui [H3O+] = [OH-]
Basica qualsiasi soluzione in cui [H3O+] < [OH-]
A 25 ° C Kw = 1 x 10-14 M2 da cui:
Soluzione acida [H3O+] > 10-7 M; [OH-] < 10-7 M
Soluzione neutra [H3O+] = 10-7M; [OH-] = 10-7 M
Soluzione basica [H3O+] < 10-7M; [OH-] > 10-7M
6. Definizione di pH
Domanda: possiamo trovare un modo per fare questi confronti utilizzando numeri più ‘facili’ da maneggiare e di immediata comprensione?
Facile! Se gli esponenti sono un problema la matematica ci aiuta: basta passare alla loro forma logaritmica!
Abbiamo visto che da un punto di vista quantitativo, il carattere neutro, acido o basico di una soluzione è determinato dalla concentrazione degli ioni H3O+ e OH-, passiamo dunque ad esprimere queste concentrazioni con una loro funzione logaritmica: definiamo il pH!
La funzione “pH” significa applicare la funzione matematica p (p minuscolo!) universalmente definita come –log cioè meno il logaritmo decimale di ‘qualcosa’ dove questo qualcosa sarà H (H maiuscolo! Simbolo dell’idrogeno) cioè alla concentrazione degli ioni H+ in soluzione (la nostra valigia blu, cioè di H3O+).
Il pH è dunque definito come:
\( pH= - log[H_3O^+]=log\frac{1}{[H_3O^+]} \)
Per esempio, tornando al piccolo intervallo di possibile variazione della concentrazione di H3O+ nel sangue, per rimanere in salute, la concentrazione deve essere compresa tra 4,47 x 10-8 M e 3,55 x 10-8 M, esprimendolo in pH, cioè facendo il log negativo di queste due concentrazioni l’intervallo diventa: pH compreso tra 7,35 e 7,45.
Questi valori sono molto più facili da ricordare e confrontare e sono quelli che si trovano nei referti delle analisi del sangue!
7. Definizione di pOH
In maniera del tutto analoga possiamo definire il pOH, cioè applicare la funzione matematica p (p minuscolo!) universalmente definita come –log (cioè meno il logaritmo decimale di ‘qualcosa’ a OH (OH maiuscolo! Ione idrossido) cioè alla concentrazione degli ioni OH- in soluzione.
Il pOH è dunque definito come:
\( pOH= - log[OH^-]=log\frac{1}{[OH^-]} \)
Abbiamo visto che da un punto di vista quantitativo, la concentrazione degli ioni H3O+ e OH- in una soluzione acquosa non può essere completamente indipendente perché deve sempre essere rispettato l’equilibrio di autoprotolisi dell’acqua, dunque deve essere sempre vero che:
\( K_w=[OH^-][H_3O^+] \)
dove Kw è una costante che a 25oC vale 1 x 10–14 M2
Passando dunque ai logaritmi sappiamo che per le loro proprietà:
\( -logK_w=-log[OH^-]+(-log[H_3O^+]) \)
che può essere scritto come
\( pK_W=pH+pOH \)
Cioè
\( -log1.00×10^{-14}=14=pH+pOH \)
Sapendo il pH si può dunque calcolare il pOH con una semplice sottrazione (e viceversa)!
E il pH può assumere valori compresi tra 0 e 14.
8. Forza di acidi e basi /1
Domanda: tutte le reazioni chimiche acido-base sono incomplete (equilibri) come quella di autoprotolisi dell’acqua?
Risposta: NO!
A seconda del tipo di acido e di base che reagiscono, la reazione può essere completa o di equilibrio e, nel secondo caso, con costanti di equilibrio che possono avere valori da molto grandi a molto piccoli.
Domanda: come possiamo dunque confrontare il comportamento degli acidi (o delle basi) tra loro?
Risposta: costruendo una scala di confronto!!
Prima di tutto bisogna definire un termine che ci permetta il confronto quantitativo: chiamiamo FORZA di un acido (o di una base) la sua tendenza a cedere il protone ad una base (o di una base a prendere il protone).
L’acido è tanto più forte tanto più facilmente cede il protone ad una base.
Analogo discorso, ma opposto, vale naturalmente per le basi! Dunque, la quantità di prodotti formati in una reazione acido-base dipende sia dalla forza dell’acido sia da quella della base reagenti.
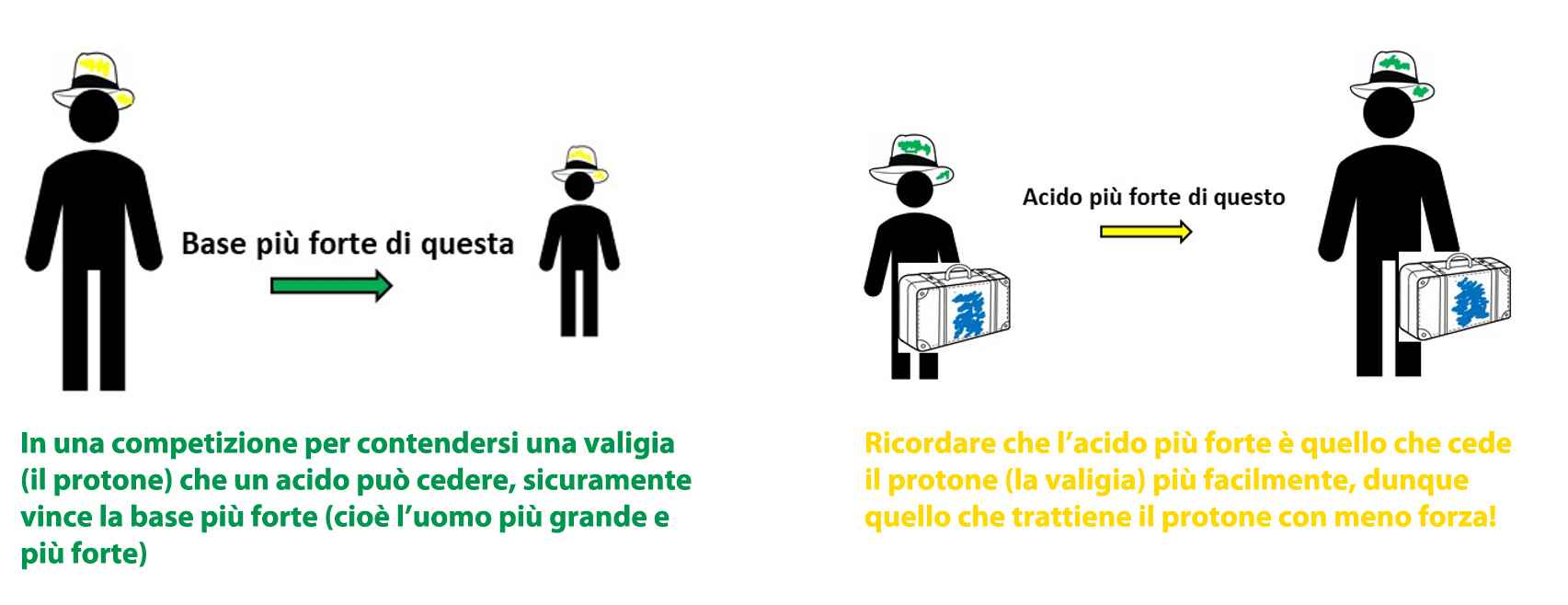
Ricordiamo il nostro scopo: predisporre una scala di forza per gli acidi e le basi.
Metodo e requisiti: prendere una base di riferimento per gli acidi e fare reagire tutti con la stessa base e un acido di riferimento per le basi e fare reagire tutte con lo stesso acido. In questo modo si avrà una scala quantitativa e confrontabile, anche se relativa al riferimento: la forza di un acido o di una base può essere misurata in base al valore della costante di equilibrio.
A parità di base, più forte è l’acido usato, maggiore è il valore di Keq
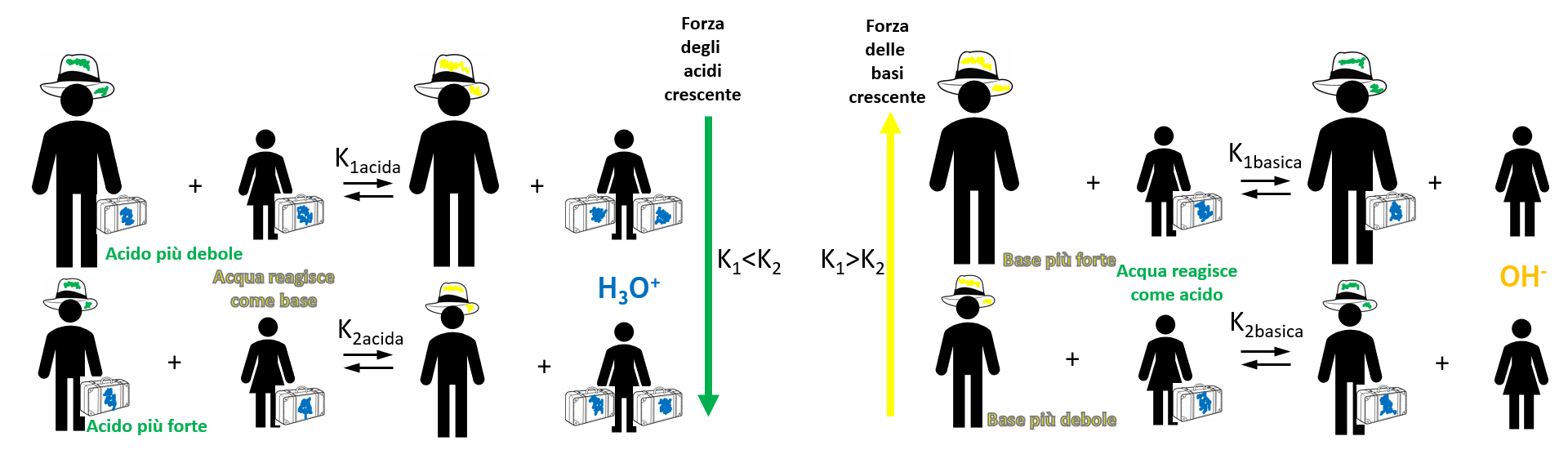
Come riferimento, sia come base che come acido è stata presa l’acqua (che essendo anfiprotica si può comportare sia da acido con le basi che da base con gli acidi) ed è stata fatta una scala di forza.
9. Forza di acidi e basi /2
RIASSUMENDO
La forza degli acidi e delle basi si riferisce alla reattività di ogni acido (o base) con l’acqua.
Definizione di acido (o base) forte: acido (o base) che reagisce in maniera quantitativa (reazione completa, singola freccia da reagenti a prodotti, cede quantitativamente il protone, non rimane acido (o base) non reagito) con l’acqua.
Definizione di acido (o base) debole: acido (o base) che reagisce in maniera incompleta con l’acqua (la reazione è un equilibrio, doppia freccia, va in entrambi i versi). Sarà caratterizzata da una sua costante di equilibrio che viene detta Ka per gli acidi e Kb per le basi.
È importante sapere se un acido (o base) è forte o debole?
Vediamo un esempio quantitativo mettendo a confronto due acidi che possiamo trovare in casa.
Un tipico acido forte è l’acido cloridrico (HCl, l’acido muriatico che si usa per le pulizie è una soluzione in acqua di acido cloridrico), un tipico acido debole è l’acido acetico (CH3COOH, contenuto nell’aceto).
HCl è un acido forte, tutto quello che mettiamo in acqua reagisce.
Reazione quantitativa, una sola freccia da reagenti a prodotti.
\( HCl+ H_2O → H_3O^ + + Cl^- \)
CH3COOH è un acido debole, solo una parte di quello che mettiamo in acqua reagisce, l’altra parte rimane solubilizzata in acqua ma non dissociata.
\( CH_3COOH+ H_2O \rightleftarrows CH_3COO^-+ H_3O^+ \)
Reazione NON quantitativa, equilibrio, due frecce significano doppio senso della reazione.
10. Calcoliamo il pH nei due casi per soluzioni alla stessa concentrazione
ACIDO FORTE
\( HCl+ H_2O → H_3O^+ + Cl^- \)
\( [HCl]=0.1M \)
0,1 M È la concentrazione iniziale di acido forte (0.1 moli di acido in 1L di soluzione).
HCl è un acido forte che si dissocia completamente (si forma in soluzione la stessa concentrazione dei prodotti della reazione di dissociazione).
\( [H_3O^+]=[Cl^-]=0.1M \)visto che per definizione è:
\( pH= -log[H_3O^+] \)
risulterà:
\( pH= -log\ 0.1 =1 \)
ACIDO DEBOLE
\( CH_3COOH+ H_2O \rightleftarrows CH_3COO^-+ H_3O^+ \)
La concentrazione iniziale di acido è 0.1 M ma l’acido è debole e quindi SOLO PARZIALMENTE dissociato.
La concentrazione dei prodotti che si formano è < 0.1M
\( [H_3O^+]<0.1M \)E quindi per una soluzione di acido debole 0.1M risulta:
\( pH>1 \)