Fissaidee 3
| Site: | Federica Web Learning - LMS |
| Course: | Scienze chimiche di base |
| Unit: | Fissaidee 3 |
| Printed by: | Guest user |
| Date: | Tuesday, 26 August 2025, 9:25 PM |
Table of contents
- 1. Indicatori colorimetrici acido-base
- 2. Caratteristiche degli indicatori colorimetrici acido-base
- 3. Soluzioni tampone: introduzione
- 4. Soluzioni tampone
- 5. Soluzioni tampone: definizioni
- 6. Soluzioni tampone: equilibrio
- 7. Soluzioni tampone: definizioni
- 8. Soluzioni tampone acide (pH < 7)
- 9. Soluzioni tampone basiche (pH > 7)
- 10. Scegliere una coppia acido-base per formare un tampone
1. Indicatori colorimetrici acido-base
È frequente l’esigenza di verificare il pH di una soluzione.
Nei casi in cui è necessaria una elevata accuratezza si ricorre ormai a metodi strumentali (pH-metro). Se i requisiti di accuratezza non sono estremamente stringenti è possibile però utilizzare degli indicatori colorimetrici di pH. Queste sono sostanze organiche che assorbono nello spettro della luce visibile e che in soluzione acquosa possono formare una coppia acido-base coniugata.
Quando la forma acida e basica nella coppia hanno colori distinti l’indicatore è BICOLORE, mentre quando solo una delle due forme è colorata viene detto MONOCOLORE.
La variazione di colore di un indicatore avviene a valori di pH compresi in un «Intervallo di viraggio».
\( HInd + H_2O \rightleftarrows Ind^{-} + H_3O^+ \)
colore acido colore basico
\( K_{ind}=\frac{[ind^- [H_3O^+]}{[HInd]} \)
\( pH = pK_{ind}+ log\frac{[Ind^-]}{HInd} \)
Approssimativamente una forma si distingue chiaramente dall’altra quando:
\( \frac{Ind^-}{HInd}>10
\)
(colore della forma basica)
\( \frac{Ind^-}{HInd}<0.1 \)
(colore della forma acida)
Per questo motivo risulta che l’intervallo di viraggio è:
\( pK_{Ind}-1 ≤pH ≤ pK_{Ind}+1 \)
2. Caratteristiche degli indicatori colorimetrici acido-base
Negli indicatori monocolore il viraggio è molto influenzato dalla concentrazione dell’indicatore, mentre nei bicolori lo è meno perché il viraggio è legato alla differenza di intensità tra i colori della forma acida e basica dell’indicatore.
L’indicatore viene scelto con una pKInd che ricade all’interno dell’intervallo di
\( pH_{misura}±1 \)
e per non influenzare il pH della soluzione vengono utilizzati in concentrazioni minime.
Il loro utilizzo è molto frequente nelle analisi volumetriche (titolazioni acido-base) che sono utilizzate per determinare la quantità incognita di una base o di un acido presenti in un volume noto di soluzione.
Gli stessi indicatori, o una serie di indicatori caratterizzati da intervalli di viaggio contigui possono essere adsorbiti su un supporto (cartina al tornasole) per permettere la rapida determinazione qualitativa del pH di una soluzione.
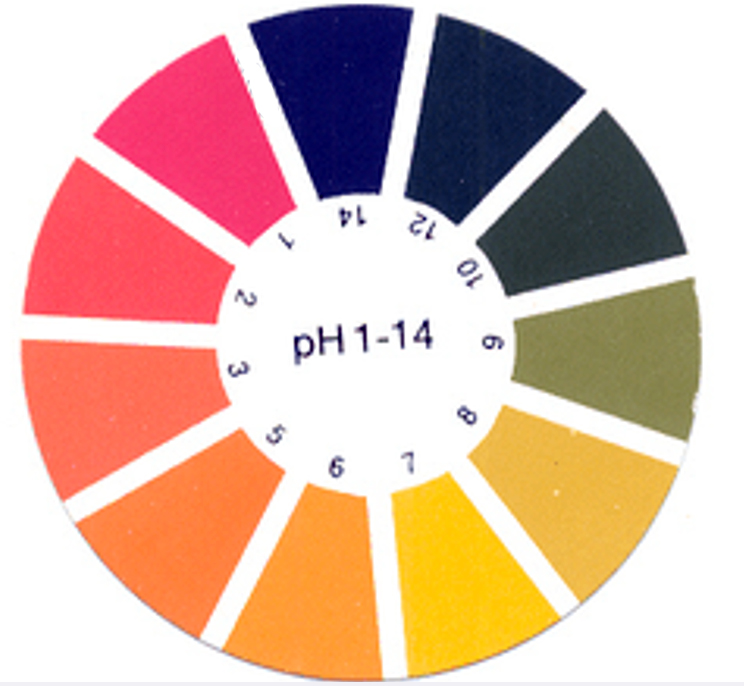
Ci sono inoltre numerosi esempi di coloranti di origine naturale che hanno proprietà di indicatori acido-base. Un esempio tra tutti è il succo del cavolo rosso, che contiene sostanze (antociani) in grado assumere colorazioni che in ambiente acido vanno dal rosso, rosa e violetto e in ambiente basico al blu, verde e giallo.
3. Soluzioni tampone: introduzione
Le soluzioni tampone sono soluzioni che hanno la caratteristica principale di mantenere il loro pH pressoché invariato in seguito all’aggiunta di moderate quantità di acido o di base.
Sono costituite da miscele di un acido debole e della sua base coniugata (un sale dell’acido), o viceversa da una base e dal suo acido coniugato (un sale della base).
Sono importanti perché in chimica e ancora di più in biochimica sono numerose le reazioni che richiedono che il pH della soluzione in cui avvengono sia mantenuto costante, anche quando dalle reazioni stesse vengono originati ioni H3O+ o OH-.
Per capirne il funzionamento consideriamo l’equilibrio di dissociazione:
\( HA+H_2O \rightleftarrows A^-+H_3O^+ \)
per una soluzione in cui è presente un acido HA ed il sale della sua base coniugata A- (ad esempio il suo sale sodico, NaA).
4. Soluzioni tampone
In questo sistema l’acido è debole – e quindi poco dissociato – in soluzione si presenta con una concentrazione iniziale (Ca)i ed è principalmente non dissociato (HA).
\( HA+H_2O \rightleftarrows A^-+H_3O^+ \)
La soluzione contiene anche A- , proveniente dalla dissociazione di un sale di HA, ad es. NaA ad una certa concentrazione iniziale (Cb)i : per questo motivo – dato che A- è essa stessa una base debole – la concentrazione di A- in soluzione è non trascurabile (in assenza del sale la concentrazione di A- sarebbe trascurabile perché HA è specie debole ed in concentrazione piuttosto elevata).
Se le due concentrazioni iniziali dell’acido e della base sono abbastanza elevate è piuttosto facile che per entrambe le specie le variazioni di concentrazione dovute alla reazione di idrolisi siano trascurabili rispetto alle concentrazioni iniziali.
5. Soluzioni tampone: definizioni
Con queste premesse è possibile definire soluzioni tampone quelle soluzioni che possiedono i seguenti requisiti:
- Contengono inizialmente una coppia acido-base coniugata
- Le concentrazioni iniziali dell’acido (Ca)i e della base (Cb)isono sufficientemente grandi da poter considerare trascurabile la dissociazione sia dell’acido che della base:
(Ca)i = (Ca)eq e (Cb)i = (Cb)eq
(Ca)i concentrazione iniziale della specie acida
(Ca)eq concentrazione della specie acida presente all’equilibrio
(similmente per (Cb)i e (Cb)eq)
\( 0,1 < \frac{(Ca)_1}{(Cb)_i} < 10
\)
(o viceversa)
6. Soluzioni tampone: equilibrio
Chiamiamo Ca e Cb (a = acido; b = base) le concentrazioni iniziali di HA e NaA, e impostiamo il bilancio di massa all’equilibrio di dissociazione di HA in presenza di NaA:
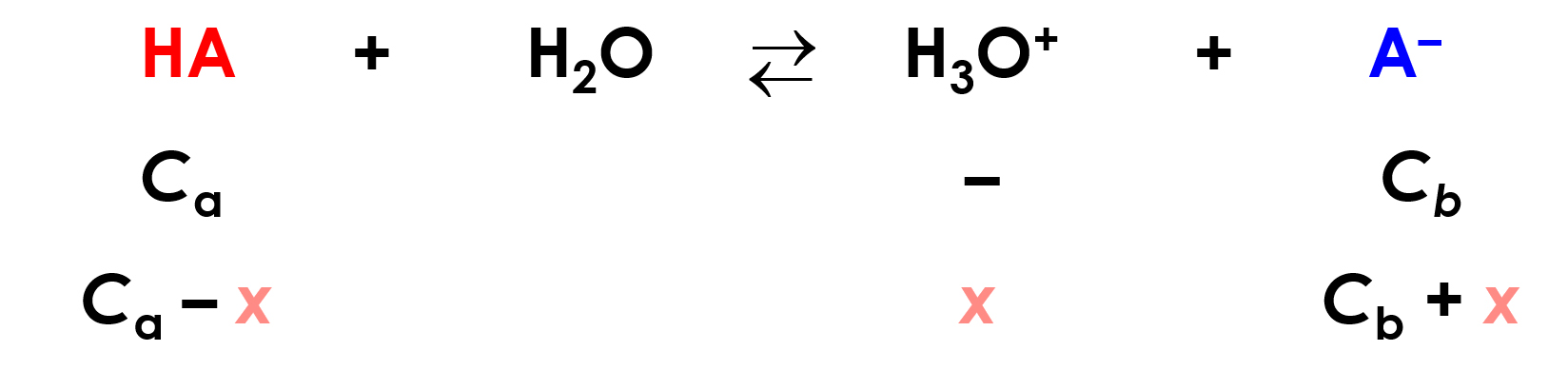
Ma x, che rappresenta la quantità di acido che si è dissociato e quindi la quantità di ioni H3O+ è solitamente trascurabile rispetto a Ca e a Cb, in quanto:
- Ka è piccola (la specie che si dissocia è un acido debole)
- HA, acido debole, è molto poco dissociato perché, per il principio di Le Châtelier, la grande quantità di A– presente in soluzione e che deriva dall’aggiunta in soluzione del sale (sodico) NaA sposta l'equilibrio verso la formazione di HA non dissociato.
\( [HA]=C_a-x ≅ Ca \)
e
\( [A^-]=C_b+ x ≅ C_b \)
da cui
\( K_a=\frac{[H_3O^+][A^-]}{[HA]} ≅\frac{[H_3O^+]C_b}{C_a} \)
Da cui si ricava
\( [H_3O^+]=K_a\frac{[HA]}{[A^-]}≅ K_a \frac{C_a}{C_b} \)
\( pH=pK_a-\frac{C_a}{C_b} \)
7. Soluzioni tampone: definizioni
Le soluzioni tampone hanno le seguenti proprietà:
(Ca)i/(Cb)i e non dal valore assoluto delle concentrazioni. Il pH non varia a seguito di concentrazioni o diluizione (fino a quando è valido il secondo punto della definizione);
8. Soluzioni tampone acide (pH < 7)
Per le soluzioni tampone caratterizzate da un pH < 7, risulta Ka(HA) > Kb(A-).
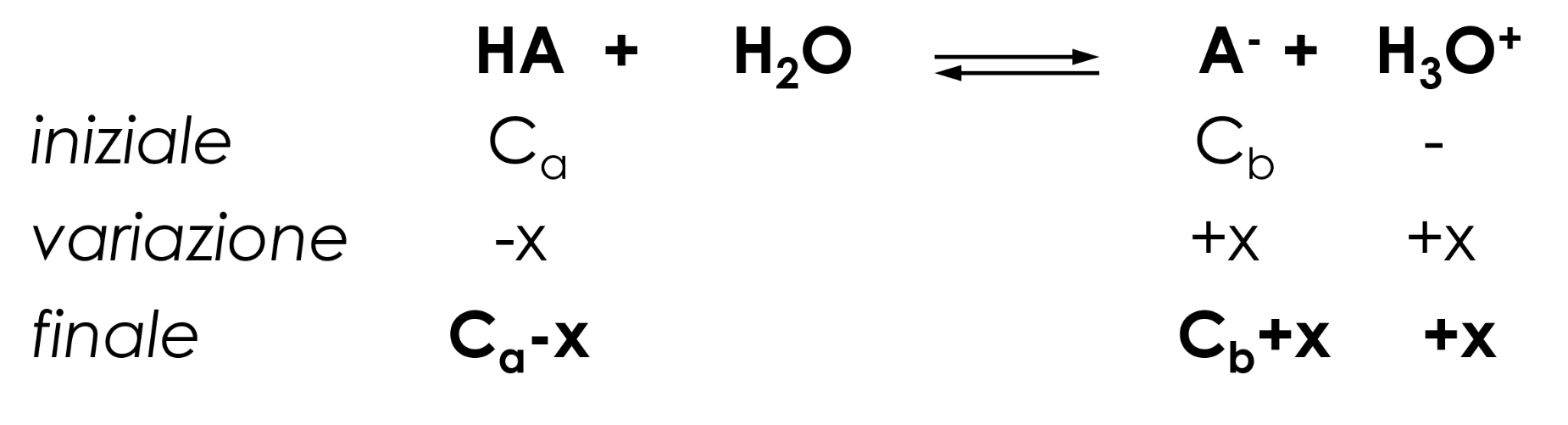
L’equilibrio di dissociazione prevalente da considerare, partendo dalle condizioni iniziali è quello acido:
\( K_a=\frac{[H_3O^+][A^-]}{[HA]} =\frac{[H_3O^+](C_b+x)}{(C_a-x)} ≅ [H_3O^+] \frac{C_b}{C_a}
\)
\( [H_3O^+] =K_a\frac{C_b}{C_a}
\)
il calcolo del pH può avvenire attraverso questa espressione
\( pH = pK_a-log \frac{C_a}{C_b} \)
9. Soluzioni tampone basiche (pH > 7)
Per le soluzioni tampone caratterizzate da un pH > 7, risulta Ka(HA) < Kb(A-).
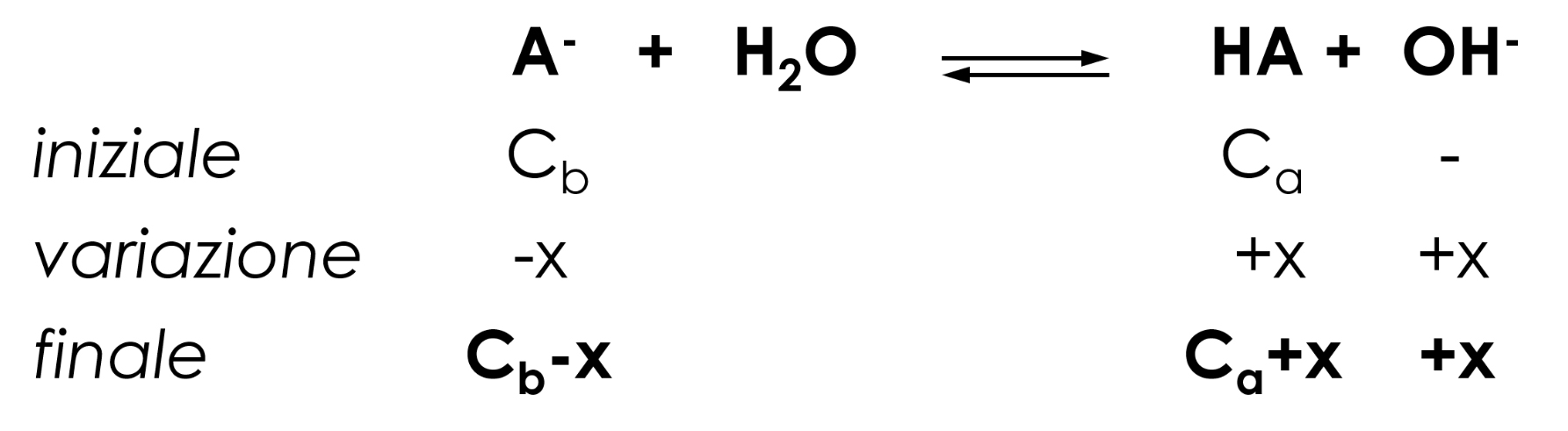
\( K_b=\frac{[OH^-][HA]}{[A^-]}= \frac{[OH^-](C_a+x)}{(Cb-x)}≅[OH^-] \frac{C_a}{C_b} \)
\( [OH^-] =K_b\frac{C_b}{C_a} \)
il calcolo del pOH e quindi del pH può avvenire attraverso questa espressione
10. Scegliere una coppia acido-base per formare un tampone
Un tampone viene scelto considerando:
- Il valore (o l’intervallo) di pH richiesti (pH di lavoro)
- la pKa della coppia acido base che lo costituisce
È molto importante scegliere un tampone che abbia un valore di pKa compreso tra un'unità di pH e il pH desiderato.
Per molte applicazioni di laboratorio è frequente l’utilizzo di tamponi a concentrazione compresa tra 25 e 200 mM.
N.B.: la concentrazione totale del tampone deve poter far fronte in modo efficiente ad aggiunte di acido e base in soluzione.
Un tampone può essere preparato:
- Mescolando quantità precise dei componenti (acido e base coniugata, quest’ultima sotto forma di un sale), al fine di ottenere le concentrazioni desiderate.
È così possibile ottenere direttamente una soluzione tampone al pH desiderato.
- Partendo da una soluzione dell’acido o del sale della base coniugata del tampone, ed aggiungendo poi rispettivamente una soluzione molto concentrata di base forte (es. NaOH) o acido forte (es. HCl) fino a raggiungere il pH desiderato. Questa soluzione viene poi diluita fino alla concentrazione finale di tampone desiderata. Questa procedura è leggermente più laboriosa - richiede però l’utilizzo del solo acido o base coniugata.
- Preparazioni commerciali con i componenti predosati.