Fissaidee 1
| Sito: | Federica Web Learning - LMS |
| Corso: | Scienze chimiche di base |
| Unit: | Fissaidee 1 |
| Stampato da: | Guest user |
| Data: | martedì, 26 agosto 2025, 21:25 |
1. Il carbonio
La chimica organica è quella parte della chimica che studia i composti del carbonio.
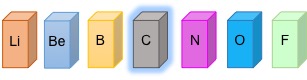
Perché il carbonio è così speciale da meritare una chimica tutta per sé? Il carbonio ha un comportamento chimico peculiare non osservato negli altri elementi.
Considera la posizione che occupa nella seconda riga della tavola periodica.
2. Idrocarburi
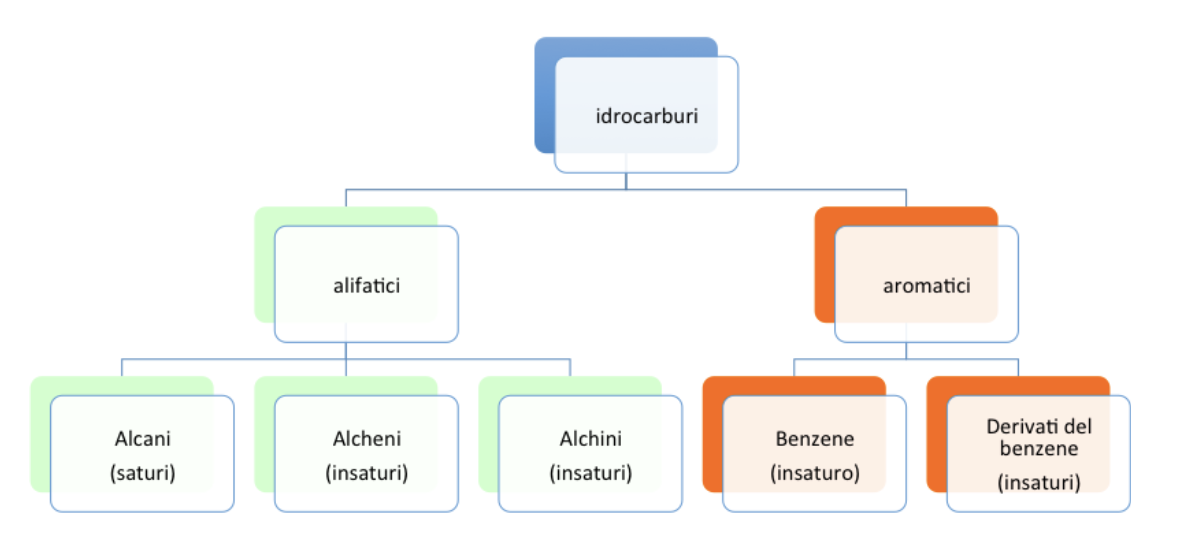
Gli idrocarburi sono composti organici nei quali gli atomi di carbonio sono legati esclusivamente ad altri atomi di carbonio e ad atomi di idrogeno.
A seconda della loro struttura si dividono in due classi principali: alifatici e aromatici.
I primi a loro volta sono suddivisi in saturi e insaturi.
Gli idrocarburi saturi presentano solo legami carbonio-carbonio singoli e prendono il nome di alcani.
Gli idrocarburi insaturi, invece, presentano uno o più legami carbonio-carbonio multipli, in particolare vengono chiamati alcheni se presentano legami carbonio-carbonio doppi e alchini se presentano legami carbonio-carbonio tripli.
La catena di atomi di carbonio degli idrocarburi alifatici lineari può chiudersi su se stessa se i due carboni alle estremità della catena si uniscono perdendo nel legarsi un atomo di idrogeno ciascuno. Si originano in questo modo idrocarburi ciclici.
Gli idrocarburi aromatici sono composti a catena chiusa (ciclici) altamente insaturi. Essi comprendono il benzene e i suoi derivati.
3. Alcani
Sono composti organici che contengono solo C e H, per questo appartengono alla più ampia classe degli idrocarburi. I legami che li costituiscono sono solo legami singoli (C-C e C-H). Non presentano gruppi funzionali.
Le fonti principali di alcani sono i giacimenti di gas naturale e di petrolio formatisi dalla decomposizione di depositi di organismi vegetali e animali.
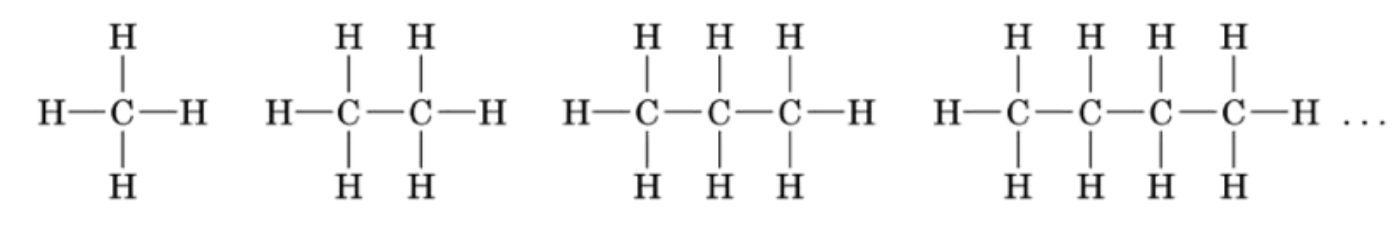
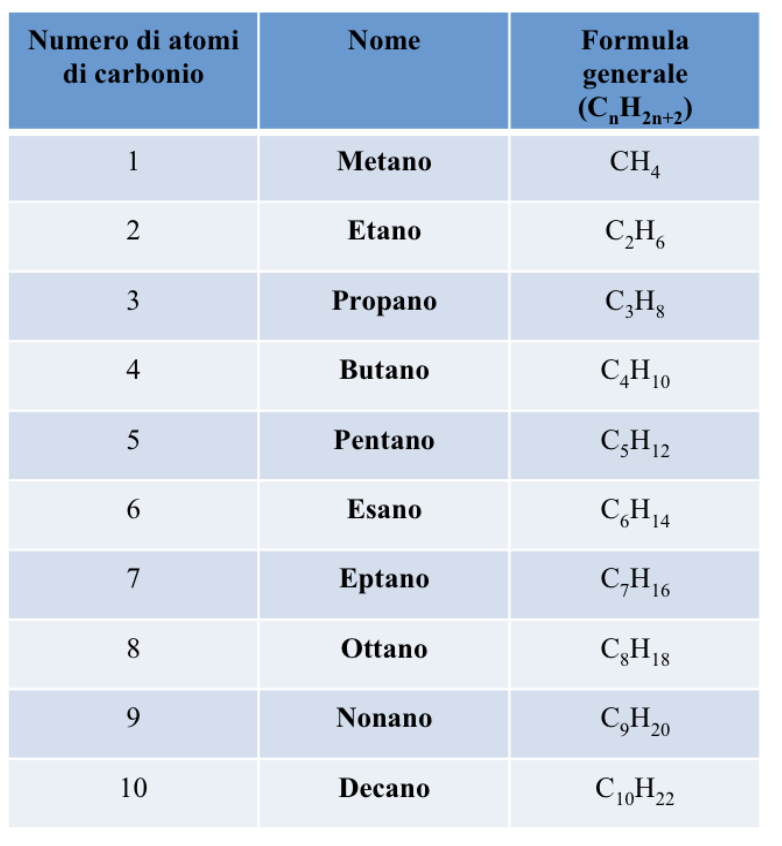
Gli alcani hanno formula generale CnH2n+2, quindi, noto il numero di atomi di carbonio in un alcano, è semplice determinare il numero di atomi di idrogeno nella molecola e la sua formula molecolare. Per esempio il butano con quattro atomi di carbonio avrà (4x2)+2, ossia 10, atomi di idrogeno, per cui la formula molecolare sarà C4H10.
La International Union of Pure and Applied Chemistry (IUPAC) ha stabilito che il nome degli alcani sia costituito da una radice che indica il numero di atomi di carbonio della catena e dal suffisso –ano che indica che il composto è un idrocarburo saturo.
Nella tabella sono riportati alcuni esempi di alcani, con l’indicazione del numero di atomi di carbonio che li costituiscono, il nome e la formula generale.
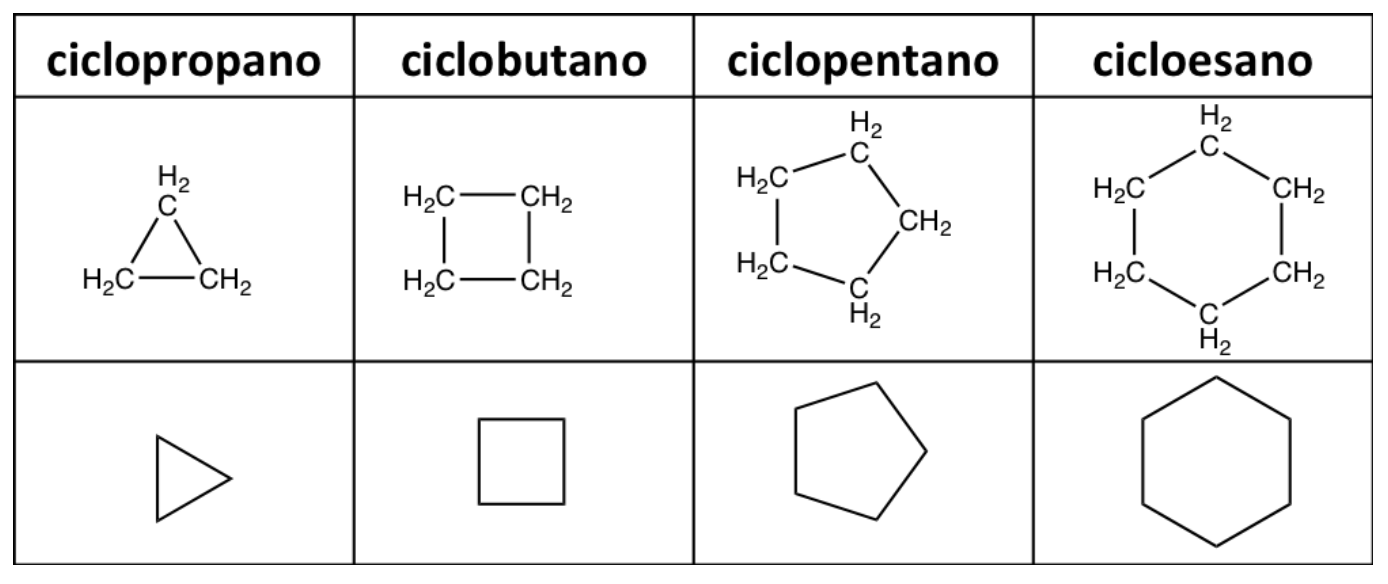
4. Cicloalcani
Gli alcani possono essere lineari o ciclici. In quest’ultimo caso gli atomi di carbonio sono disposti ad anello e questa classe di composti prende il nome di cicloalcani che sono quindi idrocarburi ciclici nei quali tutti gli atomi di carbonio dell’anello sono saturi. La loro formula generale è CnH2n ad indicare che nella chiusura della catena per formare il sistema ciclico si perdono due idrogeni rispetto all’alcano lineare.
Il nome del cicloalcano si ottiene anteponendo al nome del corrispondente idrocarburo lineare il prefisso ciclo e nominando ogni sostituente sull’anello che deve a sua volta avere un numero che ne indica la posizione.
In base a questa regola si possono nominare i cicloalcani riportati nella tabella sottostante tenendo presente che essi sono quasi sempre rappresentati utilizzando le strutture scheletriche o a segmenti. Infatti, per convenienza, quando si scrivono le strutture dei cicloalcani spesso non si indicano tutti gli atomi di carbonio e idrogeno, ma si preferisce rappresentare gli anelli come poligoni regolari aventi il numero di lati uguale a quello dei carboni che li costituiscono.
5. Cicloesano
I composti ciclici ritrovati più spesso in natura contengono anelli a sei termini perché questi anelli possono esistere in una conformazione che è quasi completamente priva di tensioni.
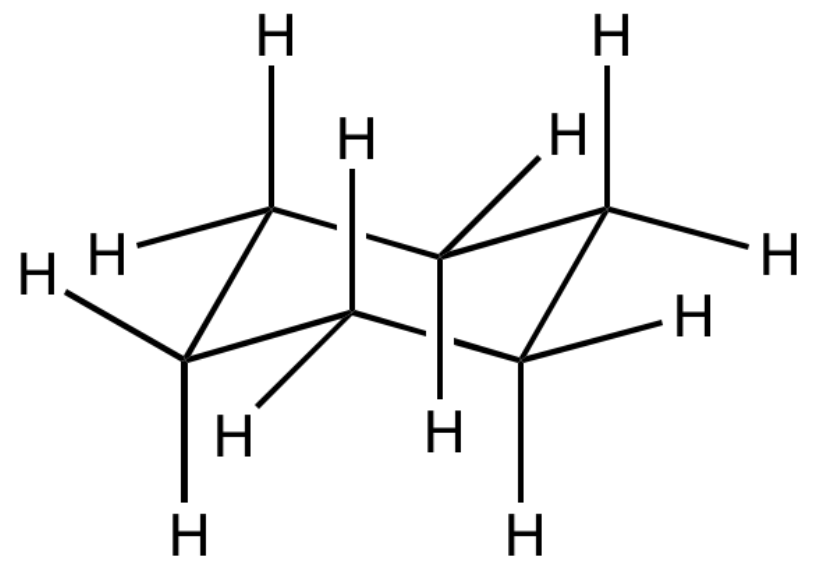
Tale conformazione è detta conformazione a sedia (osserva la figura sottostante per avere un’idea della conformazione a sedia).
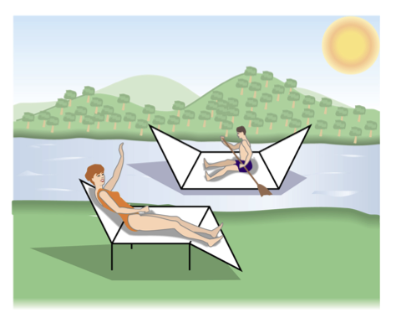
Nel conformero a sedia tutti gli angoli di legame sono di 111°, molto vicini all’angolo di legame tetraedrico ideale per i carboni saturi che è di 109.5°, e tutti i legami su carboni adiacenti sono sfalsati, per evitare tensione sterica.
Un esempio di strutture contenenti cicloalcani sono gli steroidi, un gruppo di lipidi di origine vegetale e animale costituiti da quattro anelli, tre cicloesani e un ciclopentano, condensati tra di loro.
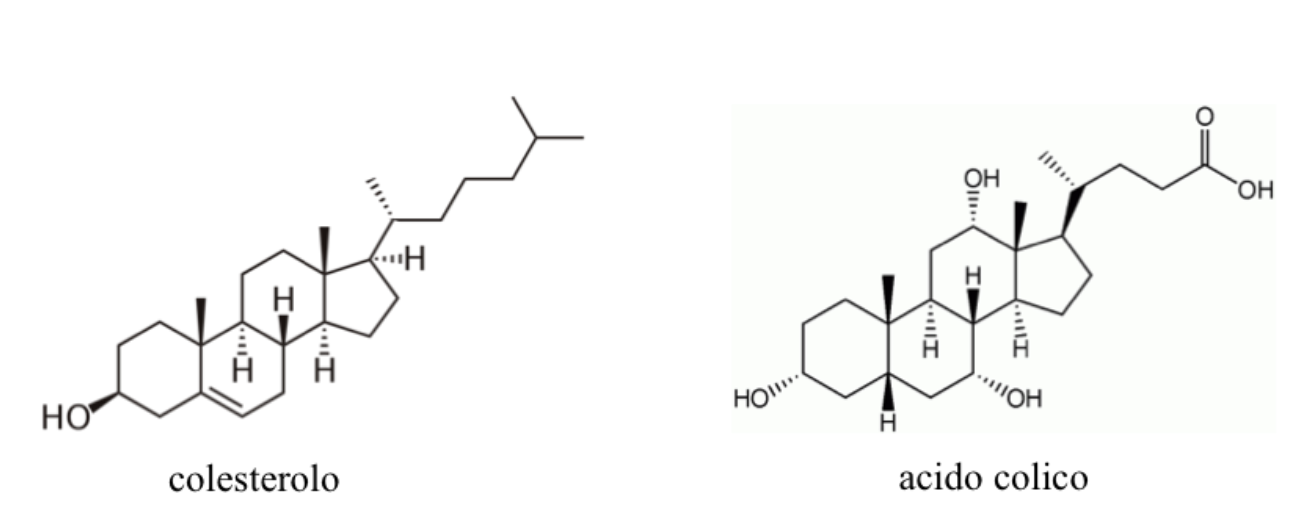
Presentano questa struttura base il colesterolo e gli acidi biliari, come l’acido colico, che è prodotto dal fegato a partire dal colesterolo e ha la funzione di emulsionare i grassi alimentari permettendone l’assorbimento.
6. Alcheni
Sono idrocarburi che contengono un doppio legame C=C, la cui presenza è identificata dal suffisso “ene” che sostituisce “ano” del corrispondente alcano.
La formula molecolare generale per un alchene aciclico è CnH2n: confrontando questa formula con quella degli alcani (CnH2n+2) si può osservare come la presenza del doppio legame porti alla diminuzione di due atomi di idrogeno, uno per ogni atomo di C coinvolto nella formazione del doppio legame.
Poiché gli alcani possiedono il numero massimo possibile di legami C-H, essi vengono definiti idrocarburi saturi. Gli alcheni invece, poiché hanno un numero di atomi di idrogeno inferiore a quello massimo consentito dalla chimica del carbonio, sono classificati come idrocarburi insaturi.
Nella tabella seguente puoi trovare alcuni esempi.
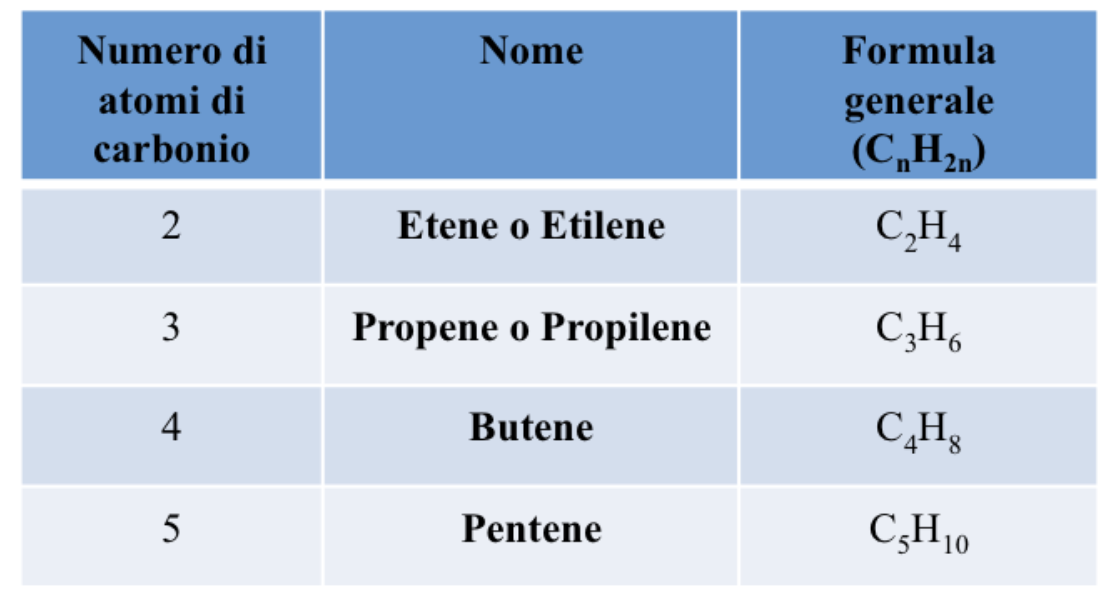
Composti che contengono due doppi legami C=C sono chiamati dieni, mentre composti organici che presentano numerosi doppi legami prendono il nome di polieni
7. Polieni
Gli alcheni svolgono importanti funzioni biologiche.
L’etene, che rappresenta l’alchene più piccolo, è un ormone vegetale che influenza la germinazione dei semi, la fioritura e la maturazione dei frutti.
Inoltre, molti dei sapori e delle fragranze prodotte dalle piante appartengono alla famiglia degli alcheni, in particolare a quella dei polieni.
Se i doppi legami di un poliene si alternano con un legame singolo, abbiamo dei polieni coniugati, i più diffusi in natura, in quanto tale disposizione dei doppi legami risulta la più stabile. Una coniugazione estesa porta all’assorbimento della luce visibile, producendo colore (la regione della luce visibile è compresa tra 400 e 800 nm).
Di seguito alcuni esempi di polieni coniugati naturali
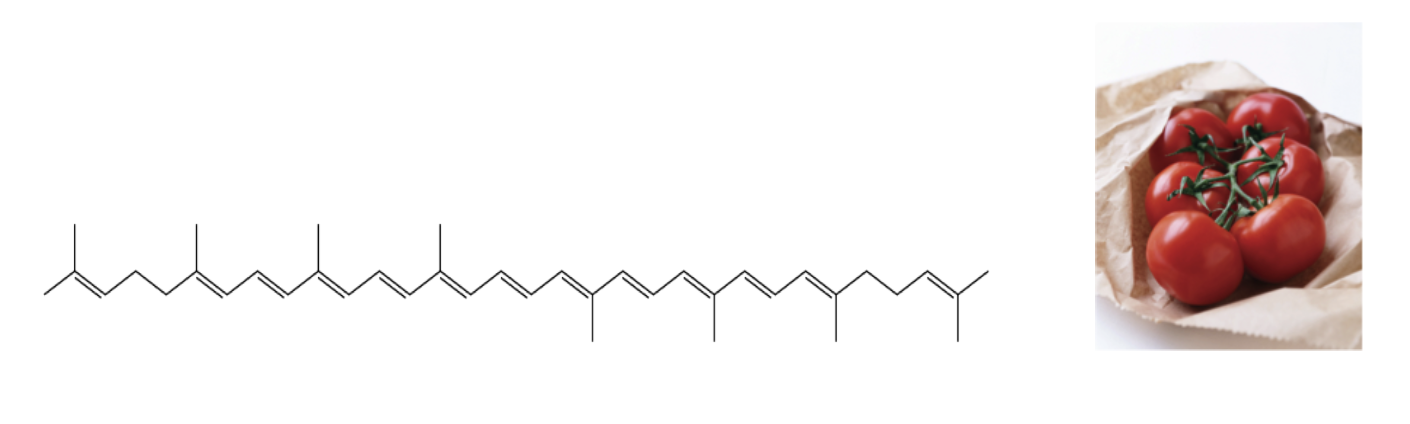
Licopene, un poliene con 11 doppi legami coniugati che è responsabile della colorazione rossa dei pomodori
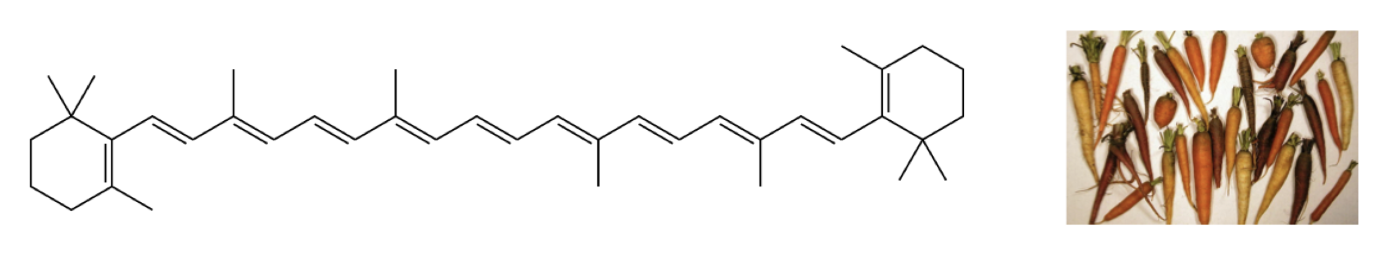
Betacarotene, poliene con 11 doppi legami coniugati che è responsabile della colorazione arancione delle carote
8. Alchini
Gli alchini sono idrocarburi che contengono un triplo legame tra due atomi di C (C≡C).
La formula molecolare generale per un alchino aciclico è CnH2n-2.
Per la nomenclatura si applicano le regole generali viste per gli alcani sostituendo il suffisso “ano” dell’alcano corrispondente, con “ino”. Se il triplo legame si trova ad un’estremità della catena, l’alchino viene classificato come un alchino terminale, gli alchini che presentano i tripli legami in qualsiasi altra posizione vengono detti alchini interni.
Gli alchini di origine naturale sono relativamente pochi, molti alchini sono stati sintetizzati dall’uomo e vengono utilizzati per preparare composti polimerici (composti costituiti dal ripetersi di unità monomeriche) di uso commerciale ampiamente diffusi e utilizzati quali plastiche e tessuti sintetici.
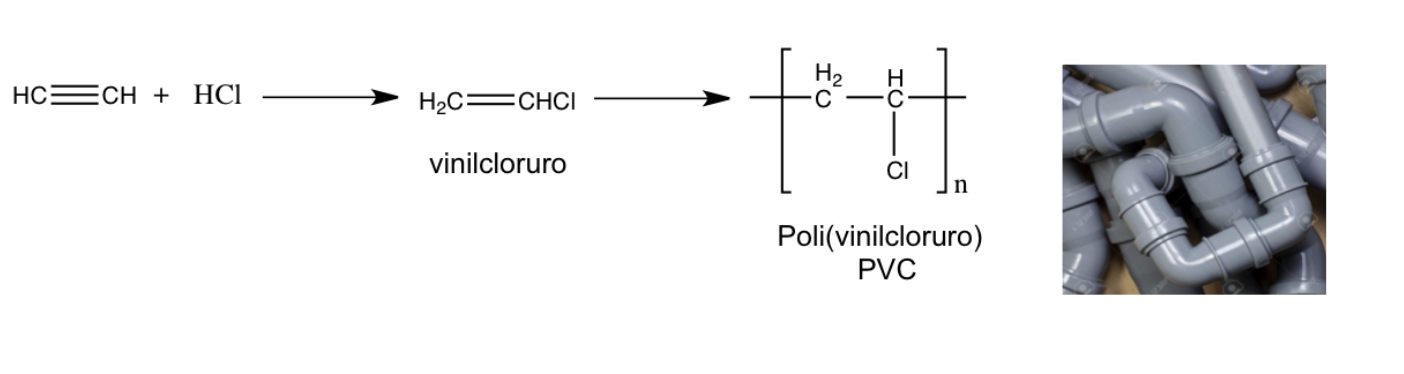
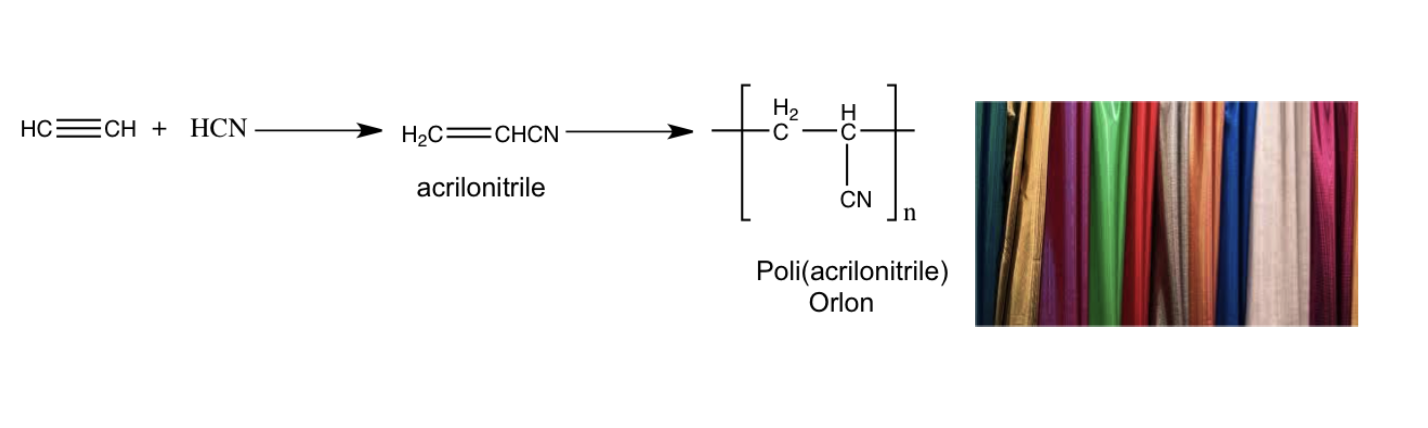
Tutti gli idrocarburi alifatici, alcani, alcheni e alchini, hanno proprietà fisiche molto simili:
- i loro punti di ebollizione aumentano all’aumentare del peso molecolare;
- sono insolubili in acqua, ma solubili in solventi non polari;
- sono meno densi dell’acqua.
9. Benzene e composti aromatici
Il termine “aromatico” è stato adoperato per classificare il benzene e i suoi derivati perché nella maggior parte dei casi presentano un odore intenso e caratteristico; da un punto di vista chimico, essi rappresentano una classe di composti che condividono alcune caratteristiche strutturali:
- sono composti ciclici;
- sono composti planari (tutti gli atomi dell’anello sono ibridati sp2);
- presentano una nuvola elettronica ininterrotta sopra e sotto il piano, (si tratta di un unico orbitale molecolare 𝜋 ottenuto dalla sovrapposizione di orbitali atomici p);
- la nuvola elettronica possiede un numero di elettroni pari a (4n + 2), dove n è un qualsiasi numero intero (n = 0, 1, 2, 3, ecc.), o, in altri termini, un numero dispari di coppie di elettroni (regola di Hückel);
- gli elettroni nell’orbitale molecolare 𝜋 sono delocalizzati per risonanza e condivisi tra tutti gli atomi del ciclo.
Il benzene è il capostipite di questa classe, infatti risponde alle caratteristiche elencate e in particolare:

- presenta 6 legami carbonio-carbonio identici;
- possiede 6 orbitali atomici p che condensano a formare un unico orbitale molecolare 𝜋 sopra e sotto il piano dell’anello;
La delocalizzazione degli elettroni 𝜋 sull’intera molecola rende i composti aromatici particolarmente stabili.
10. Derivati del benzene e idrocarburi policiclici aromatici
Altri composti aromatici sono i derivati del benzene. Di seguito alcuni esempi.
Il toluene viene usato in sostituzione del più tossico benzene, come solvente per sciogliere resine, grassi, oli, vernici, colle, coloranti e molti altri composti.

Lo stirene viene usato, attraverso un processo di polimerizzazione, nella produzione di gomme sintetiche, polistirolo e plastiche rinforzate.

Altri composti aromatici sono gli idrocarburi policiclici aromatici (IPA). Un esempio è il benzopirene

Si forma (tra i 300 e i 600°C) tutte le volte che un composto organico non viene bruciato completamente. Per questo è presente (ad esempio) nel fumo di sigaretta, nei gas di scarico dei motori diesel, nei fumi prodotti dalla combustione di biomasse e nelle carni bruciate.
Se inalato o ingerito ripetutamente, è ritenuto tra le sostanze più tossiche, in quanto causa mutazioni genetiche che possono portare a cancerogenesi.