Fissaidee 2
| Sito: | Federica Web Learning - LMS |
| Corso: | Scienze chimiche di base |
| Unit: | Fissaidee 2 |
| Stampato da: | Utente ospite |
| Data: | martedì, 26 agosto 2025, 20:07 |
Indice Unit
- 1. Disposizione degli elettroni nell’atomo di carbonio
- 2. Formazione di legami tra gli atomi
- 3. I legami singoli del carbonio
- 4. Ibridazione sp3 degli orbitali e geometria spaziale
- 5. I legami doppi del carbonio
- 6. Ibridazione sp2 degli orbitali e geometria spaziale
- 7. legami tripli del carbonio
- 8. Ibridazione sp degli orbitali e geometria spaziale
- 9. Riassumendo
- 10. Grafite e diamante
1. Disposizione degli elettroni nell’atomo di carbonio
Ogni atomo fa muovere i suoi elettroni all’interno di spazi, chiamati orbitali atomici, aventi distanza dal nucleo, forma ed energia definite e caratteristiche. La collocazione degli elettroni in tali spazi segue delle regole precise:
- Vengono riempiti prima gli spazi (orbitali atomici) più vicini al nucleo, poi via via gli altri.
- Ogni orbitale atomico può essere occupato al massimo da due elettroni, aventi spin opposti.
- In presenza di più orbitali atomici equivalenti (definiti degeneri), gli elettroni si dispongono in maniera da occuparne il maggior numero possibile.
L’atomo di carbonio possiede sei elettroni e cinque differenti orbitali atomici in cui disporli:
- l’orbitale 1s che presenta forma sferica e si trova nel livello 1, a minore distanza dal nucleo e a più bassa energia. Ospita due elettroni, considerati elettroni interni.
- L’orbitale 2s, anche esso a forma sferica e che si trova nel livello 2, a maggiore distanza dal nucleo ed a più alta energia, ospita due elettroni, considerati elettroni esterni, che si muovono nella parte più esterna della sfera, in quanto la zona interna (detta zona nodale) non può essere occupata sulla base di regole dettate dalla meccanica quantistica.
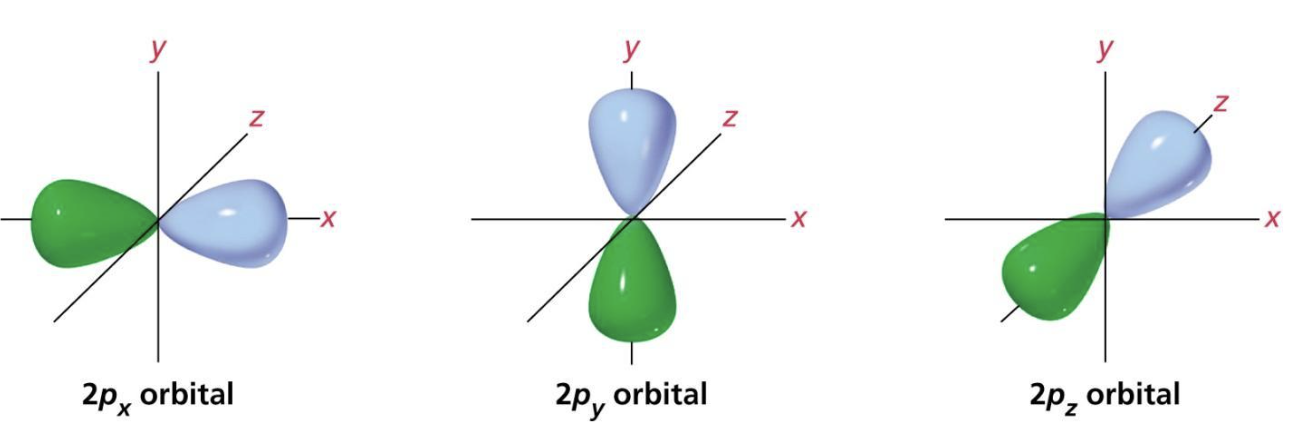
- gli orbitali 2px, 2py e 2pz, sono tre orbitali degeneri (cioè aventi la stessa energia) a forma di doppio lobo, si trovano nel livello 2, a maggiore distanza dal nucleo ed a più alta energia (superiore all’orbitale 2s), i primi due (2px e 2py) ospitano un elettrone ciascuno, considerati elettroni esterni, il terzo orbitale (2pz) è vuoto.
2. Formazione di legami tra gli atomi
Gli atomi si legano tra loro utilizzando i loro elettroni più esterni (elettroni di valenza).
Per spiegare perché gli atomi formano legami, Lewis propose che: «Un atomo ha la massima stabilità quando il suo livello più esterno è completo e non ha elettroni a energia più alta».
Secondo questa teoria un atomo tende a cedere, acquistare, o condividere elettroni per «completare» il suo livello energetico più esterno e riempire gli spazi (orbitali atomici) di cui dispone. Per fare questo l’atomo di carbonio né cede, né dona i suoi elettroni, ma li condivide. Per tale motivo la maggior parte dei legami nei composti organici si forma attraverso la condivisione di due elettroni tra due atomi: legami covalenti. Lo spazio condiviso formato dalla sovrapposizione di orbitali atomici viene chiamato orbitale molecolare.
Consideriamo ad esempio la formazione della semplice molecola di idrogeno attraverso l’instaurarsi di un legame covalente tra due atomi di idrogeno: in questo caso il legame risulta dalla combinazione di due orbitali atomici 1s per formare un orbitale molecolare σ.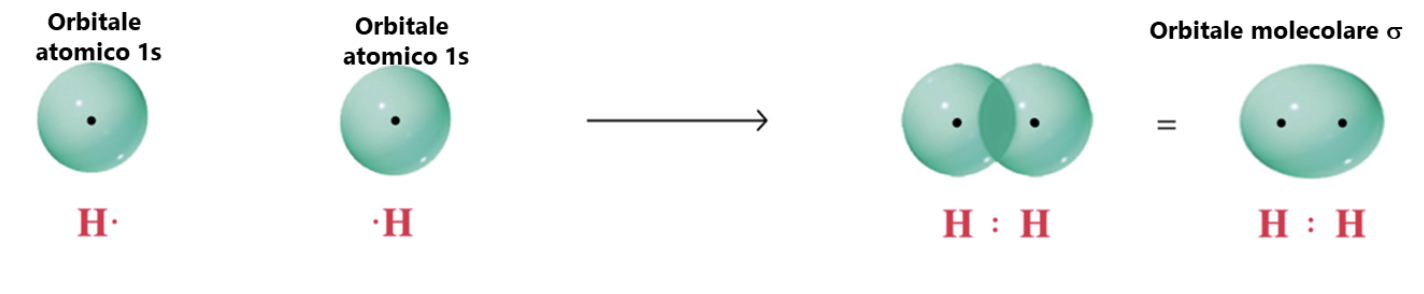

Per questo motivo il carbonio forma quattro legami covalenti, che possono essere 4 legami singoli, 2 legami singoli e 1 legame doppio, 1 legame singolo e 1 legame triplo.
3. I legami singoli del carbonio
La molecola più semplice in cui riconosciamo un atomo di carbonio impegnato a formare 4 legami covalenti singoli è il metano.
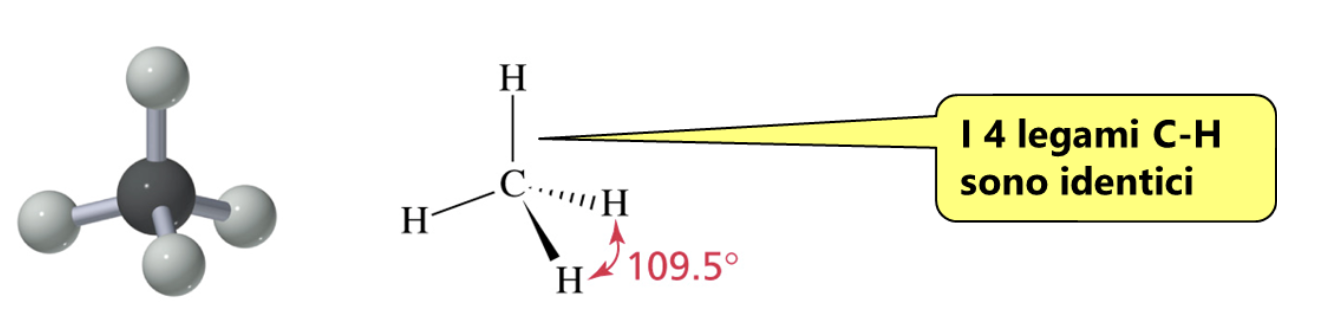
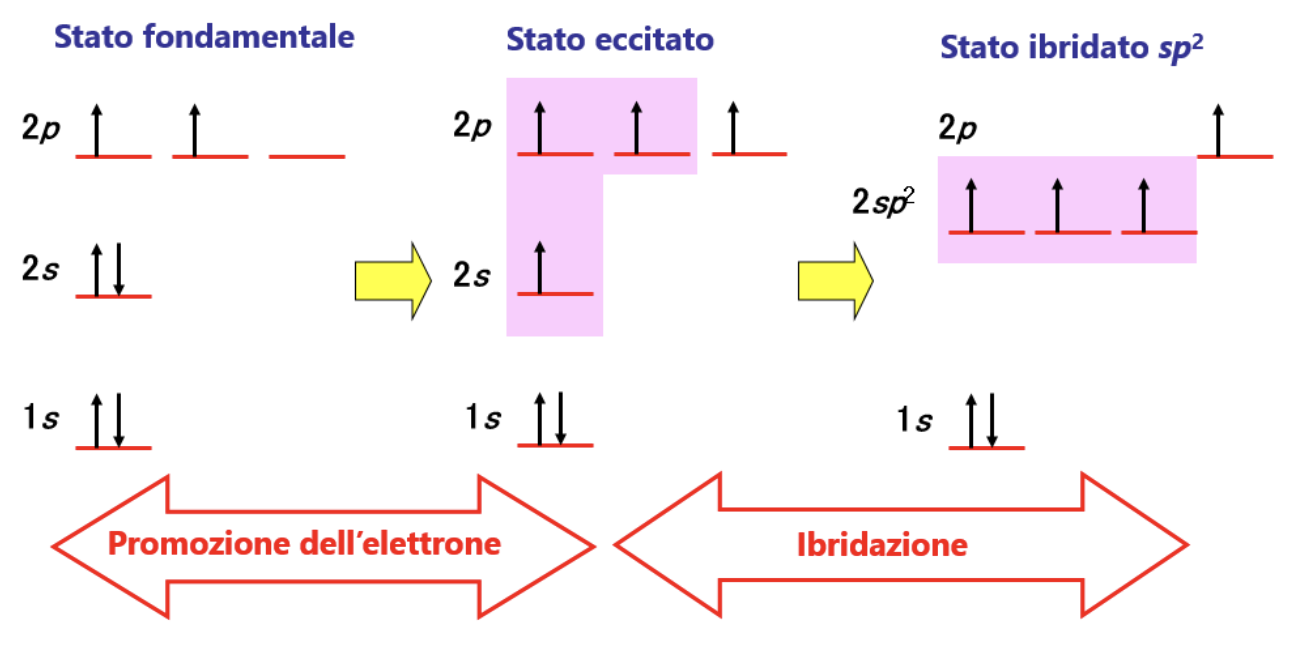
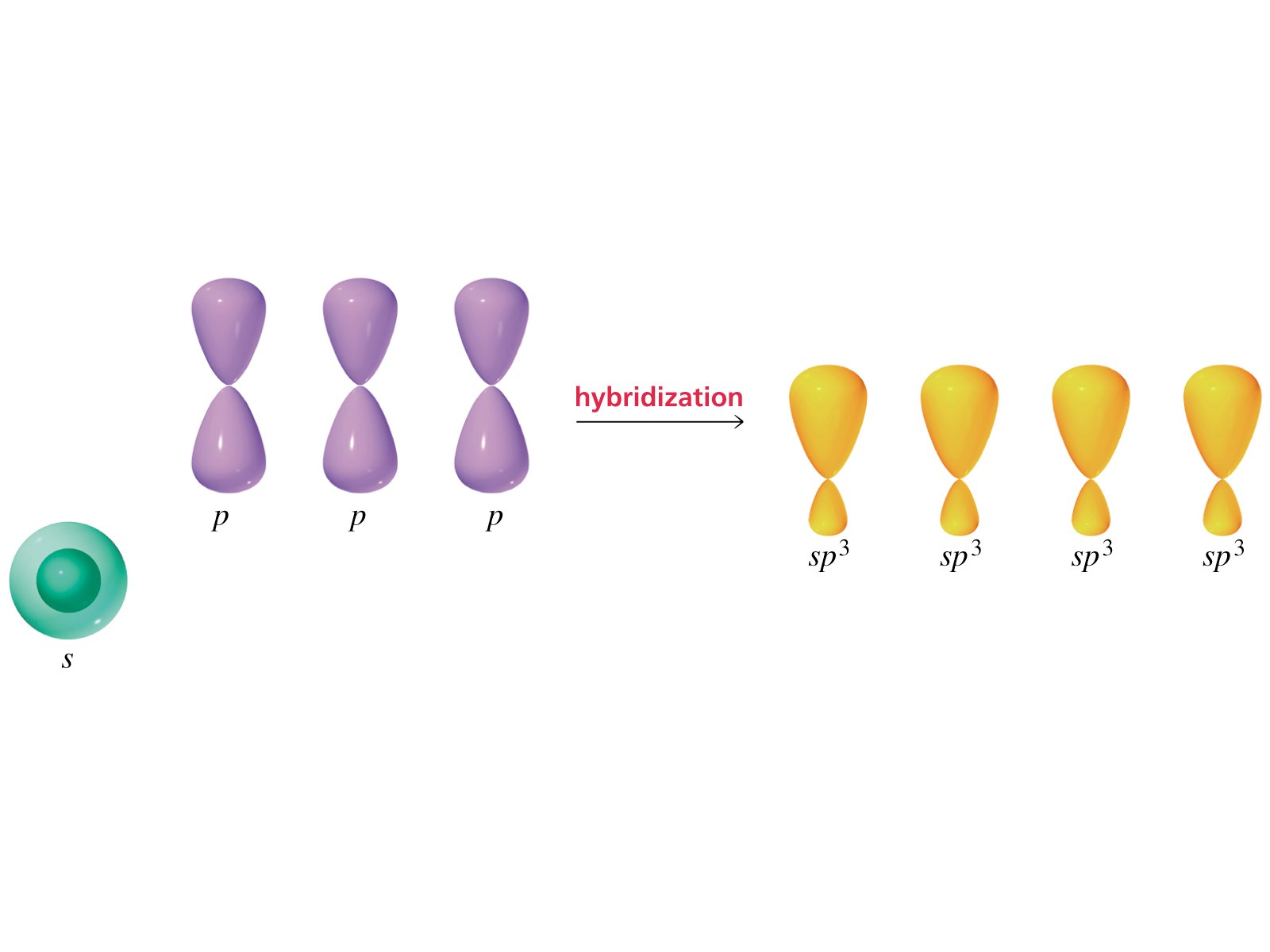
Sperimentalmente si è osservato che i quattro legami carbonio-idrogeno (C-H) sono identici come forza e lunghezza e che il carbonio si dispone al centro e i 4 idrogeni ai vertici di un tetraedro regolare. Come fa il carbonio a formare 4 legami identici utilizzando 4 elettroni esterni che si trovano in orbitali atomici diversi? Per spiegare l’evidenza sperimentale i chimici ricorrono alla Teoria dell’Ibridazione. In pratica si assume che il carbonio “ibridi” i suoi orbitali esterni differenti per numero di elettroni ospitati, forma ed energia (stato fondamentale), trasferendo un elettrone dall’orbitale 2s all’orbitale 2pz vuoto (stato eccitato) e ridistribuendo i 4 elettroni spaiati che così ottiene in 4 orbitali atomici identici per forma ed energia (stato ibridato sp3).
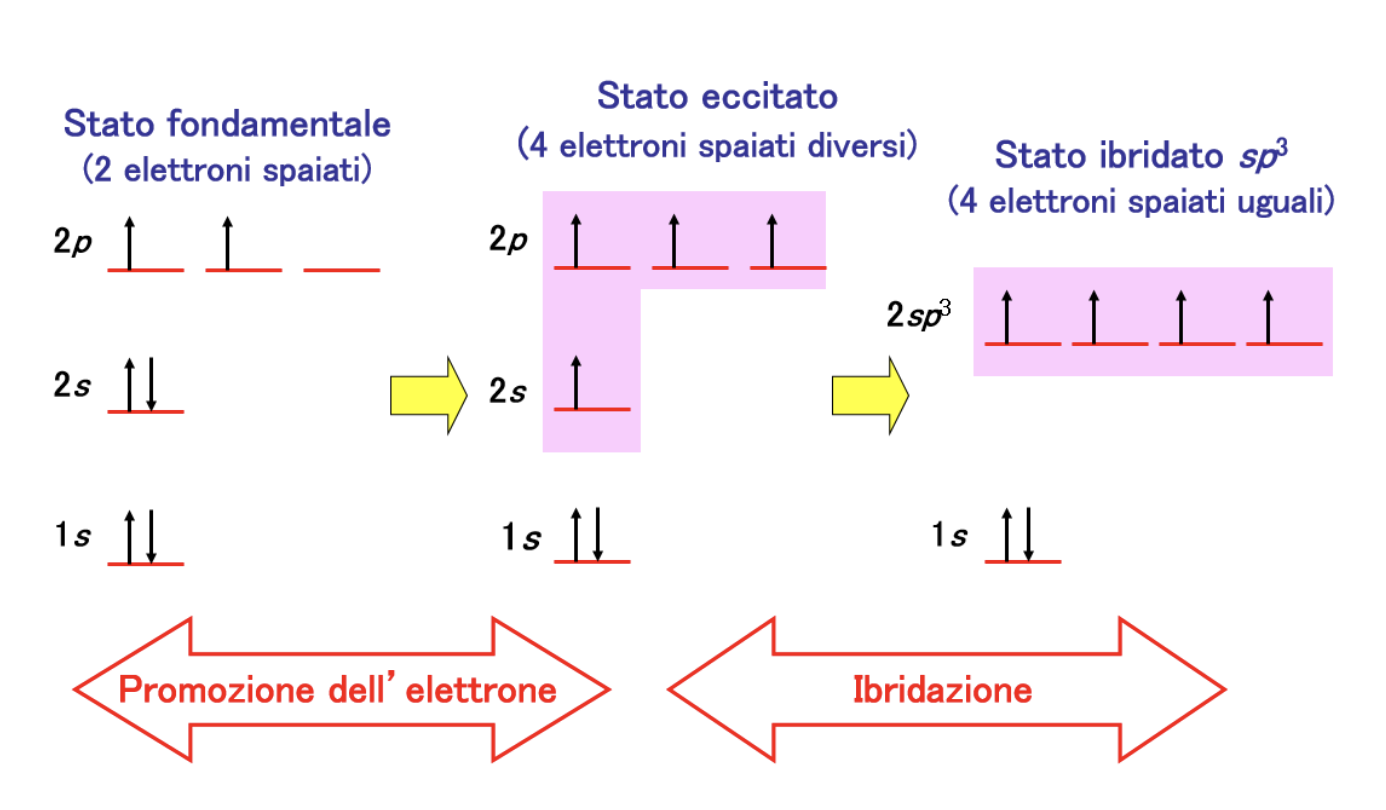
Nella figura è illustrato il processo descritto.
4. Ibridazione sp3 degli orbitali e geometria spaziale
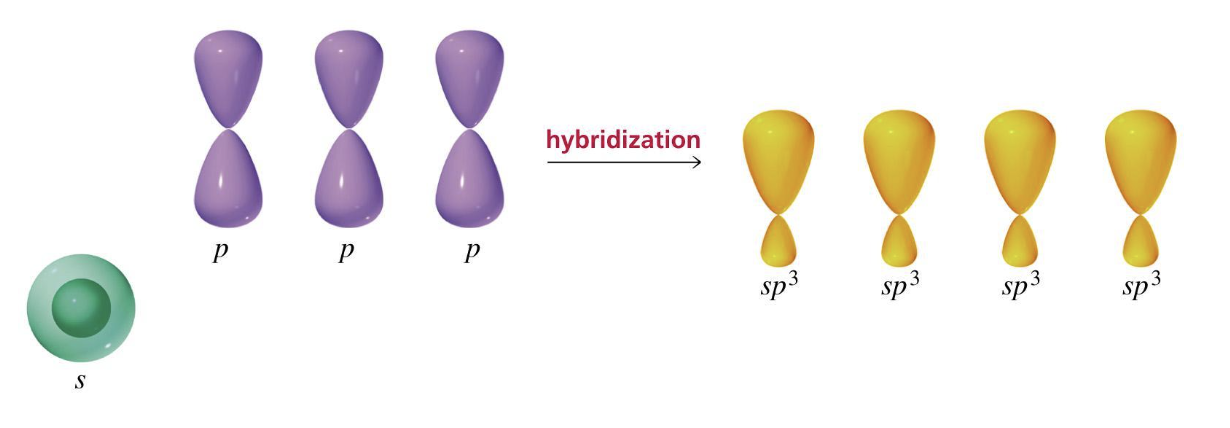
Per rappresentare le regioni spaziali definite dagli orbitali ibridati si ricorre ad una forma intermedia tra quella sferica e quella bilobata: l’orbitale atomico ibridato sp3 presenta due lobi non simmetrici, di cui uno più esteso dell’altro.
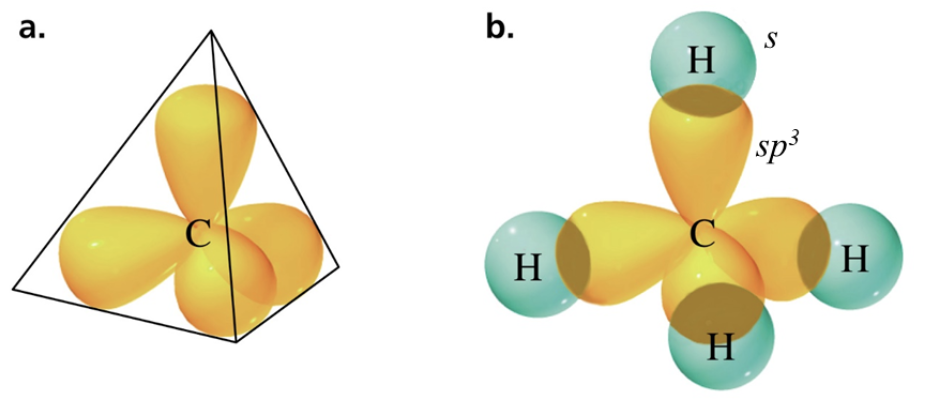
Gli orbitali atomici utilizzati dagli atomi nella formazione dei legami determinano la geometria spaziale della molecola. L’angolo di legame, che è l’angolo avente per vertice il carbonio e per lati gli assi congiungenti i nuclei dei due atomi consecutivi legati, nel carbonio sp3 è: 109.5°.
I 4 atomi legati dal carbonio si dispongono ai vertici di un tetraedro [figura a]. Le coppie di elettroni che formano i legami tra due atomi si dispongono nello spazio in modo da risultare il più lontano possibile per minimizzare la repulsione elettronica. (Secondo la teoria VSEPR: Valence Shell Electron Pair Repulsion, cioè repulsione delle coppie elettroniche nel guscio di valenza)
Nel metano la sovrapposizione tra un orbitale atomico ibridato sp3 del C e un orbitale atomico s di un H genera un orbitale molecolare (o legame) 𝜎. Nel metano il C forma 4 legami σ identici [ figura b] genera un orbitale molecolare (o legame) 𝜎. Nel metano il C forma 4 legami σ identici.
Per semplificare nella rappresentazione degli orbitali atomici sp3 i lobi minori sono omessi.
5. I legami doppi del carbonio
Una seconda modalità utilizzata dal carbonio per formare quattro legami covalenti, è quella di legare due atomi attraverso due legami singoli ed un terzo atomo (che può essere un atomo di carbonio, un ossigeno o un azoto) attraverso un legame doppio.
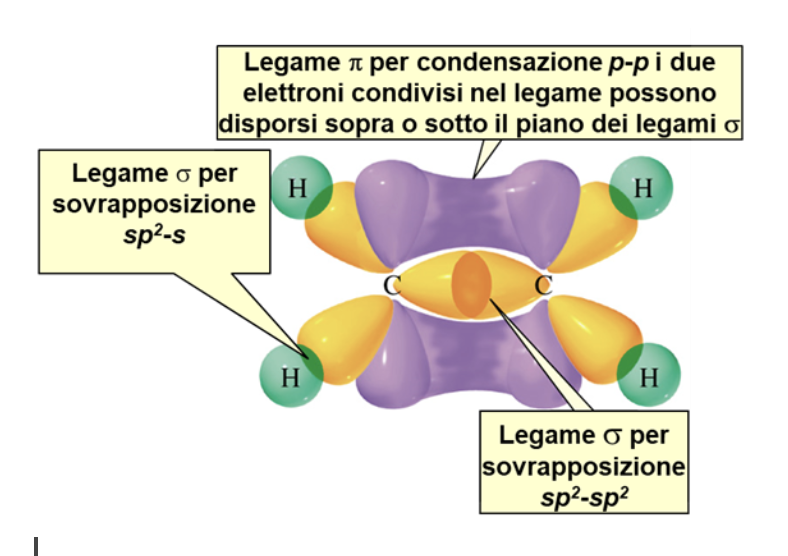
La molecola più semplice in cui riconosciamo questa situazione è l’etene (comunemente noto come etilene), in cui troviamo un carbonio legato, con due legami singoli di tipo σ, a due atomi di idrogeno e, con un legame doppio, di cui il primo di tipo σ e il secondo di tipo π, ad un altro atomo di carbonio. Sperimentalmente si è osservato che i tre legami di tipo σ giacciono su uno stesso piano mentre il quarto legame, di tipo π si trova indifferentemente al di sopra o al di sotto di tale piano.
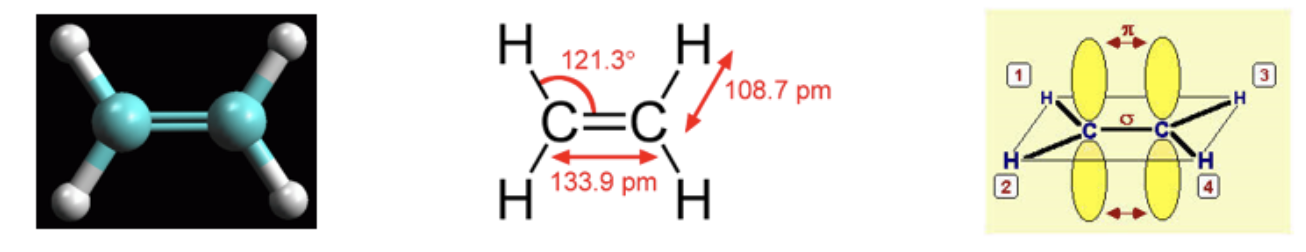
Per spiegare questa evidenza sperimentale si teorizza una seconda modalità di ibridazione. Ancora una volta si assume che il carbonio “ibridi” i suoi orbitali esterni differenti per numero di elettroni ospitati, forma ed energia (stato fondamentale), trasferendo un elettrone dall’orbitale 2s all’orbitale 2pz vuoto (stato eccitato) e ridistribuendo 3 dei 4 elettroni spaiati che così ottiene in 3 orbitali atomici identici per forma ed energia (3 orbitali atomici sp2) e lasciando un elettrone in un orbitale p (ad energia leggermente superiore). Nella figura è illustrato il processo di ibridazione sp2 descritto.
6. Ibridazione sp2 degli orbitali e geometria spaziale
Gli orbitali atomici utilizzati dagli atomi nella formazione dei legami determinano la geometria spaziale della molecola. L’angolo di legame del carbonio ibridato sp2 è 120° .
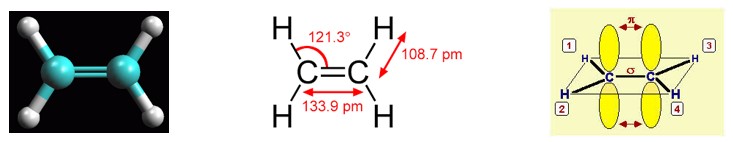
Il carbonio si dispone al centro ed i tre atomi legati ai vertici di un triangolo equilatero (geometria trigonale planare). Tale disposizione spaziale è quella che garantisce la massima distanza e quindi la minor repulsione elettronica degli elettroni di legame che si trovano in orbitali sp2 (teoria VSEPR). Il quarto elettrone utilizzato per formare il quarto legame, si trova in un orbitale atomico, p, perpendicolare al piano degli orbitali sp2 e che presenta un lobo al di sopra e uno al di sotto di tale piano.
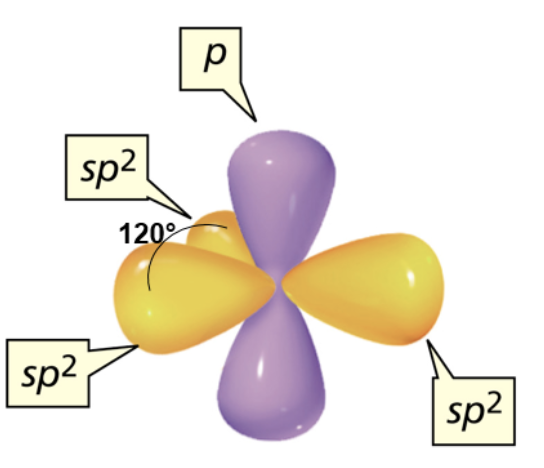
La forma degli orbitali atomici sp2 è simile a quella riportata precedentemente per gli orbitali sp3
Anche in questo caso nella rappresentazione i lobi minori sono omessi.
Ciascun carbonio nell’etene forma tre legami σ in un piano e un legame π sopra e sotto tale piano. I sei atomi che costituiscono l’etene (2 carboni, C, e 4 idrogeni, H) si trovano tutti in uno stesso piano.
Il doppio legame C-C consiste di un legame σ (formato dalla sovrapposizione di due orbitali atomici sp2) e un legame π (formato dalla condensazione di due orbitali atomici p).
7. legami tripli del carbonio
Una terza, ed ultima, modalità utilizzata dal carbonio per formare quattro legami covalenti, è quella di legare un atomo attraverso un legame singolo ed un secondo atomo (che può essere un atomo di carbonio, o un azoto) attraverso un legame triplo.
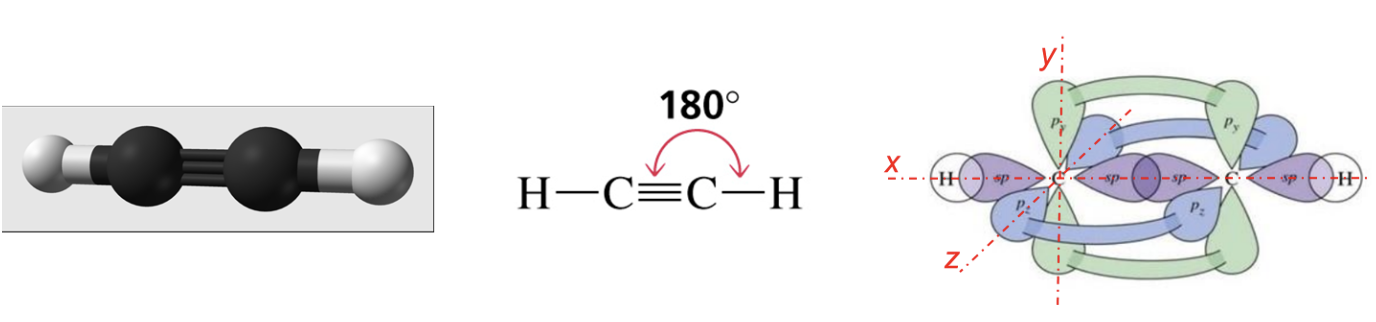
La molecola più semplice in cui riconosciamo questa situazione è l’etino (comunemente noto come acetilene), in cui troviamo ciascun carbonio legato, con un legame singolo di tipo σ, ad un atomo di idrogeno e, con un legame triplo, di cui il primo di tipo σ, mentre il secondo e il terzo di tipo π, ad un altro atomo di carbonio. Sperimentalmente si è osservato che i due legami di tipo σ giacciono su una stessa retta (asse x) mentre i due legami di tipo π si creano rispettivamente sull’asse y e sull’asse z perpendicolari tra loro e rispetto alla retta su cui giacciono i legami σ.
Per spiegare questa evidenza sperimentale si teorizza una terza modalità di ibridazione. Ancora una volta si assume che il carbonio “ibridi” i suoi orbitali esterni differenti per numero di elettroni ospitati, forma ed energia (stato fondamentale), trasferendo un elettrone dall’orbitale 2s all’orbitale 2pz vuoto (stato eccitato) e ridistribuendo 2 dei 4 elettroni spaiati che così ottiene in 2 orbitali atomici identici per forma ed energia (2 orbitali atomici sp) e lasciando gli altri 2 elettroni in due orbitali p (ad energia leggermente superiore). Nella figura è illustrato il processo di ibridazione sopra descritto.
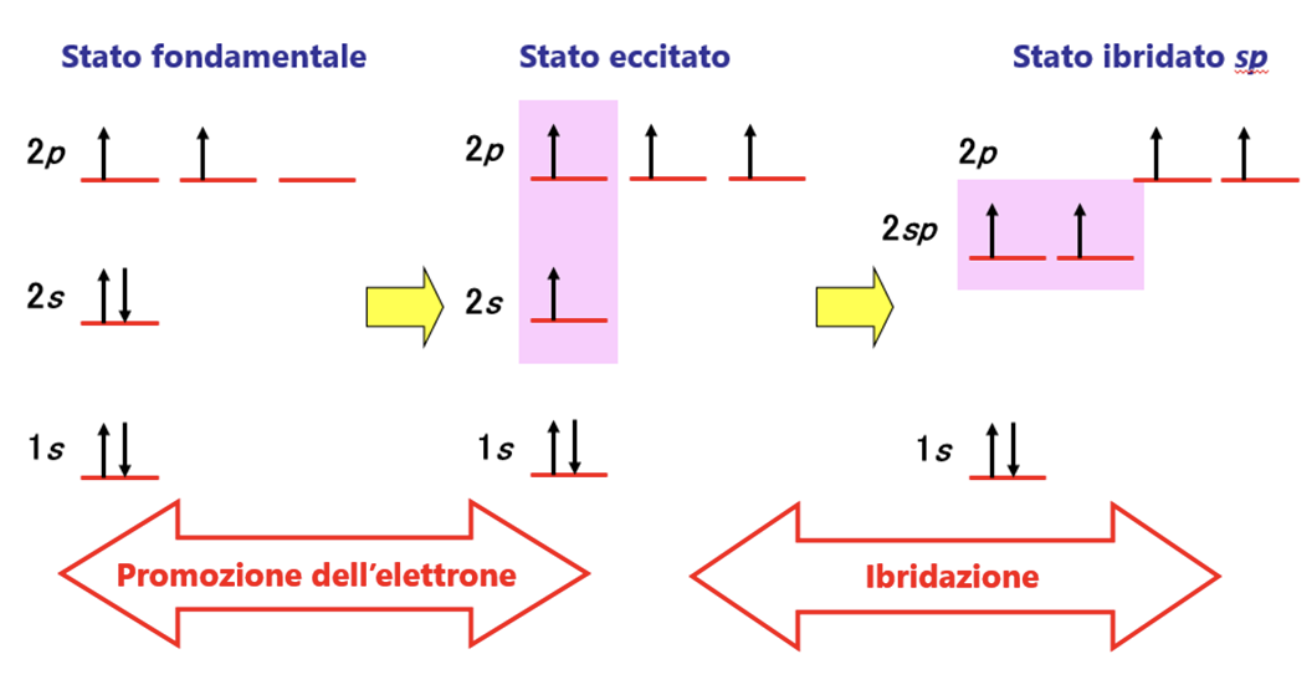
8. Ibridazione sp degli orbitali e geometria spaziale
Gli orbitali atomici utilizzati dagli atomi nella formazione dei legami determinano la geometria spaziale della molecola. Un carbonio ibridato sp dispone due elettroni in orbitali atomici sp che puntano in direzioni opposte, e i due elettroni rimanenti in orbitali atomici, p, perpendicolari tra loro ed alla retta degli orbitali sp.
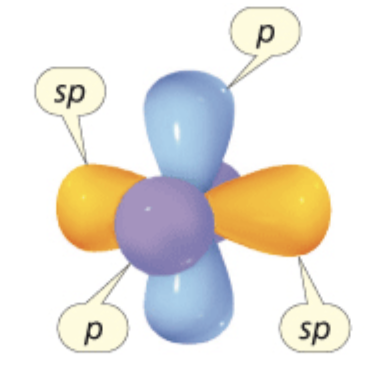
Nella rappresentazione i lobi minori degli orbitali sp sono omessi.
L’angolo di legame del carbonio ibridato sp è 180°. Il carbonio si dispone al centro e i due atomi con cui si lega agli estremi di un segmento (geometria lineare). Tale disposizione spaziale è quella che garantisce la massima distanza e quindi la minor repulsione elettronica degli elettroni di legame che si trovano in orbitali sp (teoria VSEPR).
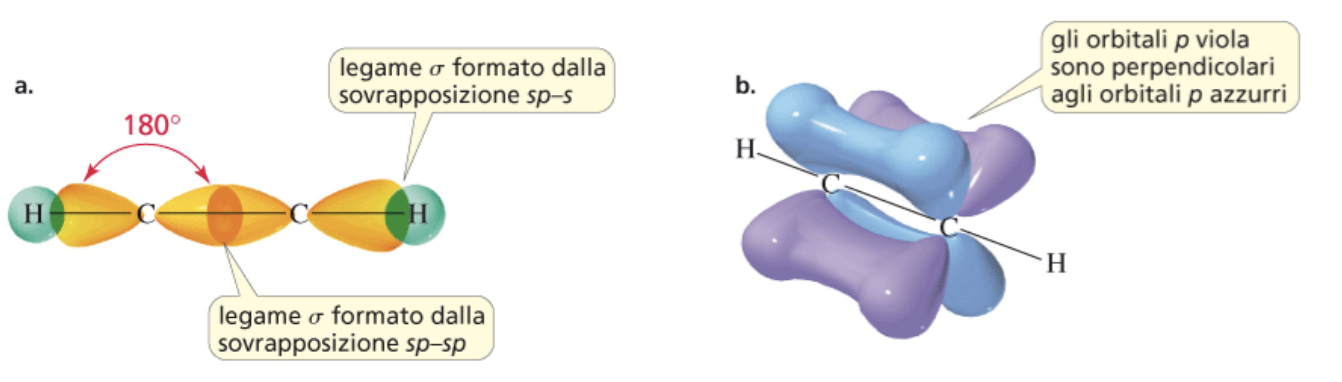
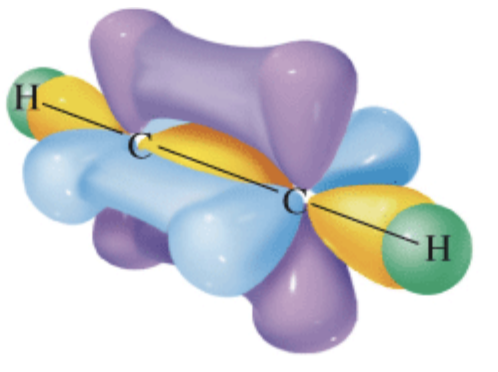
Nell’etino un orbitale atomico sp di un carbonio condensa con un orbitale atomico sp dell’altro carbonio per dare un legame, o orbitale molecolare, di tipo σ. Il restante orbitale atomico sp dello stesso carbonio forma un altro legame σ con l’orbitale s dell’idrogeno disposto dalla parte opposta (figura a). I due legami π si formano per condensazione laterale dei due orbitali atomici px e dei due orbitali atomici py dei due carboni
9. Riassumendo
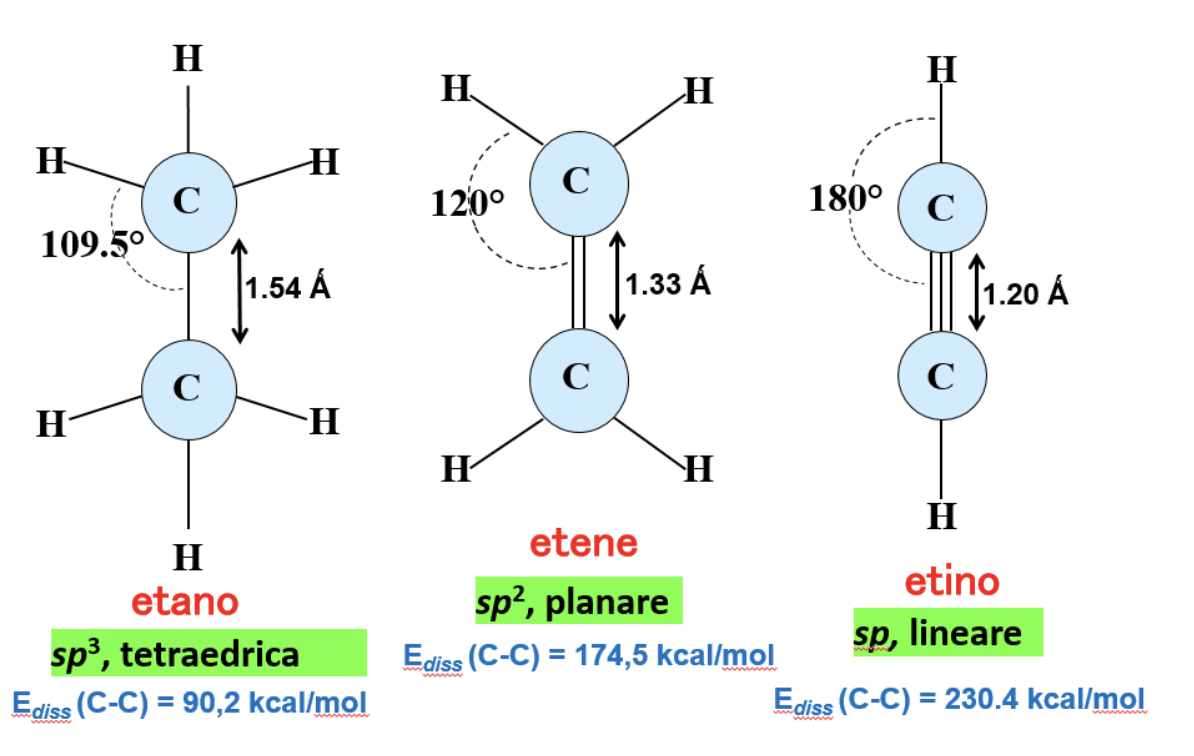
Nella figura sono riassunte e confrontate le caratteristiche dei tre possibili stati di ibridazione del carbonio.
Un carbonio ibridato sp3 presenta geometria tetraedrica e angoli di legame pari a 109.5°.
Un carbonio ibridato sp2 presenta geometria trigonale planare e angoli di legame di 120°.
Un carbonio ibridato sp presenta geometria lineare e angoli di legame pari a 180°.
La distanza, in figura espressa in Ångström (1 Å = 1x10-10 m = 0.1 nm) tra due carboni ibridati sp è minore della distanza tra due carboni ibridati sp2, che a sua volta è minore della distanza tra due carboni sp3. Al diminuire della distanza aumenta la forza del legame. Un legame σ ottenuto per sovrapposizione di due orbitali atomici sp è più corto e più forte di un legame σ ottenuto per sovrapposizione di orbitali atomici sp2, che a sua volta è più corto e più forte di quello ottenuto per sovrapposizione di due orbitali atomici sp3.
L’energia necessaria a separare due carboni legati, energia di dissociazione di legame (Ediss (C-C)) in figura espressa in kcal/mol (1 kcal = 4.18 kJ) aumenta a seconda che i due carboni siano legati con legame singolo, doppio o triplo. Per rompere un triplo legame occorre ovviamente più energia rispetto a quella necessaria a rompere un legame doppio, a sua volta superiore a quella necessaria a rompere un legame singolo. Il primo legame π è leggermente più facile a rompersi del secondo, che a sua volta è significativamente più facile a rompersi del legame σ.
10. Grafite e diamante
La differenza che può fare l’ibridazione è illustrata dal diamante e dalla grafite, che appaiono molto diversi, ma sono due forme dello stesso elemento: il Carbonio.
La grafite presenta atomi di carbonio ibridati sp2 disposti secondo maglie esagonali su piani legati da forze assai deboli.
Il diamante è caratterizzato da una struttura assai compatta con intense forze di attrazione tra gli atomi di carbonio ibridati sp3. Ciascun atomo di carbonio è legato covalentemente ad altri quattro atomi di carbonio. Ogni diamante è quindi una molecola unica (solido covalente) costituita da un enorme numero di atomi di carbonio distanti 0,154 nm l'uno dall'altro.
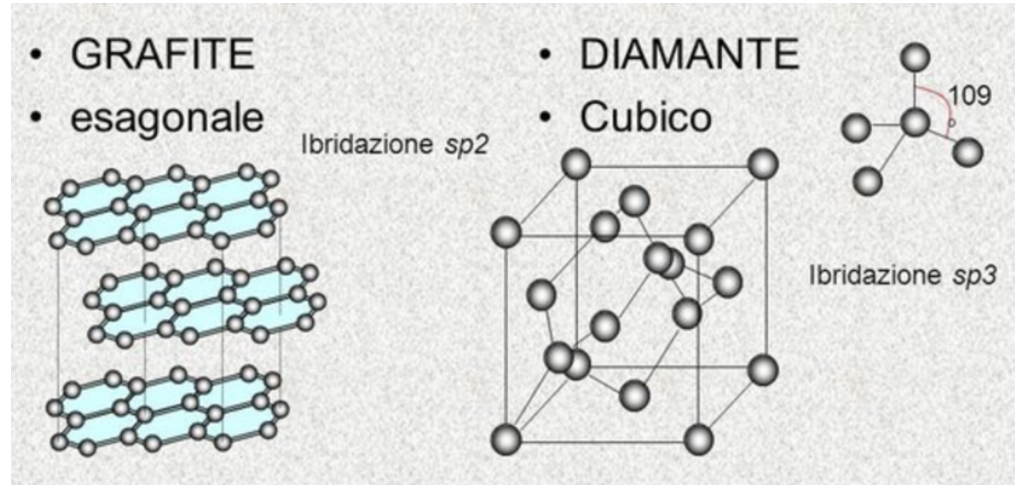
Il debole legame tra gli strati di atomi nella grafite, giustifica l’estrema facilità con cui questo materiale si sfalda (si pensi alla mina della matita, dove scrivendo non si fa altro che lasciare strati di grafite sul foglio).

Viceversa, l’energia necessaria a rompere i legami tra gli atomi di carbonio nel diamante risulta essere molto elevata, tant’è che tale materiale presenta un’elevatissima temperatura di fusione ed una straordinaria durezza: per sfaccettare un diamante, infatti, è necessario usare un altro diamante.
