Fissaidee 3
| Site: | Federica Web Learning - LMS |
| Course: | Scienze chimiche di base |
| Unit: | Fissaidee 3 |
| Printed by: | Utente ospite |
| Date: | Tuesday, 26 August 2025, 7:01 PM |
Table of contents
- 1. La solubilizzazione e la formazione di miscele
- 2. Miscele omogenee
- 3. Miscele eterogenee
- 4. Interpretazione submiscroscopica delle miscele omogenee
- 5. Interpretazione submiscroscopica delle miscele eterogenee
- 6. Distinguere una miscela da una sostanza pura
- 7. Separazione di miscele
- 8. Decantazione e filtrazione
- 9. Centrifugazione
- 10. Distillazione
- 11. Cromatografia
1. La solubilizzazione e la formazione di miscele
Abbiamo visto che il modello particellare permette di interpretare il mescolamento di una sostanza con sé stessa. Vediamo ora come possiamo interpretare il fenomeno del mescolamento, quando sono coinvolte particelle di sostanze diverse.
Consideriamo di nuovo la situazione già vista del mescolamento di due gas. Stavolta consideriamo lo stesso assetto sperimentale visto nella Unit 2, ma considerando due diverse sostanze gassose. Ipotizziamo di avere due quantità uguali di due gas diversi che occupano due contenitori di identico volume separati fra loro da una parte rimovibile e con le estremità chiuse da due pistoni mobili:
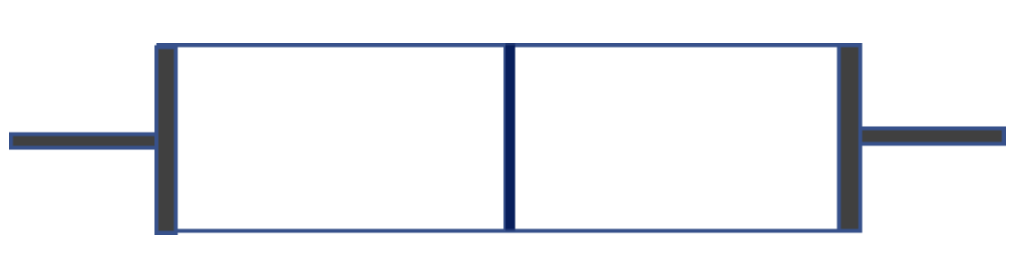
Dal punto di vista della rappresentazione con il MP la situazione è questa:
Il gas a sinistra lo possiamo rappresentare in questo modo:

E il gas nella parte destra del recipiente in un modo analogo, ma rappresentando con una diversa icona le particelle:

Se rimuoviamo la parete mobile i gas tenderanno ad occupare tutto la spazio a loro disposizione.

Possiamo rappresentare nel modo seguente la nuova situazione

Dal punto di vista macroscopico non osserviamo alcun cambiamento, abbiamo un numero doppio di particelle che occupa un volume doppio di spazio. Il rapporto fra numero di particelle e volume è quindi invariato. Siamo però di fronte a qualcosa di muovo. La rimozione della parete mobile ha determinato un mescolamento delle due sostanze: abbiamo prodotto un miscuglio. Il modello particellare ci mostra che il mescolamento è un processo al termine del quale le sostanze coinvolte rimangono inalterate, anche se il corpo che si produce vedremo non avrà più le stesse caratteristiche delle sostanze di cui è costituito.
In questa Unit ci occuperemo da vicino dei miscugli, osservando caratteristiche e proprietà e riconoscendone l’enorme diffusione nel mondo che ci circonda.
2. Miscele omogenee
La miscela che abbiamo formato mescolando due gas è un tipico esempio di miscela omogenea. Una miscela omogenea possiede una importante caratteristica: è costituita da un’unica fase. In tali miscele, infatti, non è possibile scorgere discontinuità fra diverse porzioni del corpo della miscela. I chimici utilizzano il termine soluzione per indicare una miscela omogenea.
Gli esempi di soluzioni omogenee sono numerosissimi. Due di questi sono l’acqua zuccherata e l’acqua salata, entrambe soluzioni Solido/Liquido.

In genere indichiamo come soluto il componente solido che viene portato in soluzione, negli esempi fatti lo zucchero e il cloruro di sodio, e come solvente il liquido nel quale il soluto viene dissolto. In entrambi i casi precedenti il soluto è quello più comune e frequente: l’acqua.
Le soluzioni possono essere costituite da un numero variabile di soluti disciolti nel solvente. Un esempio di questa tipologia è la comune acqua potabile o una qualsiasi acqua minerale che presenta un discreto numero di Sali minerali dissolti.

Altri esempi di soluzioni che si incontrano nella vita quotidiana sono il vino (privo di fondo!), l’aceto, la grappa ecc..
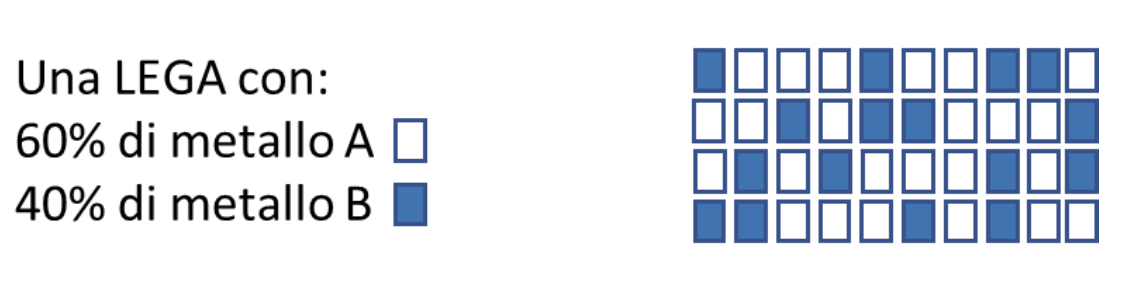
Anche le leghe rientrano nella categoria delle soluzioni, essendo miscele omogenee Solido/Solido. Tra le leghe più comuni ricordiamo l’ottone costituito da rame (il solvente) e lo zinco (il soluto), nella proporzione massima del 40% e il bronzo, costituito da rame (solvente) e stagno (soluto) nella proporzione massima del 30%.
La cera delle candele è un altro esempio di una soluzione solida di svariati idrocarburi, ossia composti costruiti da catene di numerosi atomi di carbonio (da 20 a 40)
3. Miscele eterogenee
Nelle miscele eterogenee, al contrario di quanto accade nelle soluzioni, è possibile identificare due o più fasi. Un esempio comune di miscela eterogenea è una miscela (Solido/Liquido) costituita da sabbia e acqua.

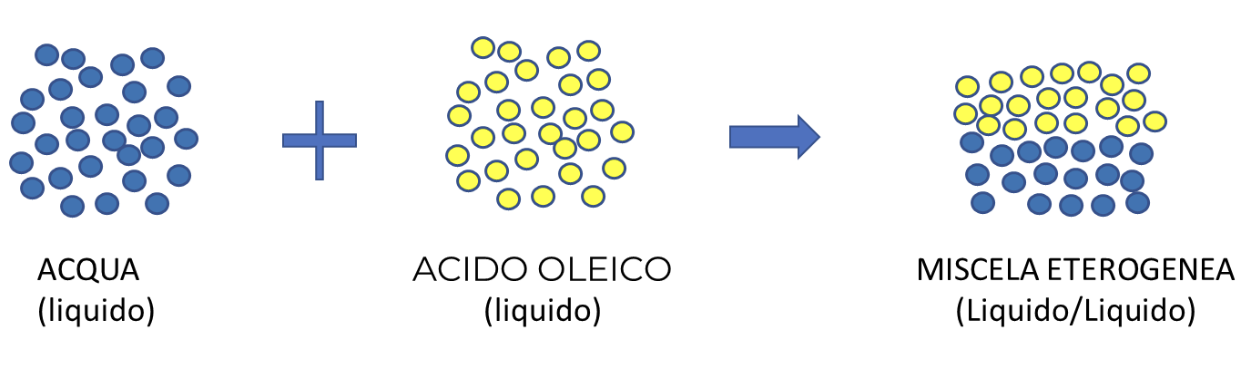
Un altro esempio è dato dalla miscela di acqua e olio. Se mescoliamo insieme questi due liquidi e li agitiamo vigorosamente inizialmente si formerà un corpo apparentemente omogeneo che se lasciato a riposo tenderà a stratificarsi in due fasi distinte, dove l’olio, per la sua minore densità si posizionerà sopra l’acqua.

Le rocce sono un esempio molto comune e diffuso di miscele eterogenee Solido/Solido

In taluni casi le miscele eterogenee possono presentarsi sotto forme complesse, apparentemente omogenee e stabili nel tempo. Si possono classificare queste miscele eterogenee con termini specifici.
Le sospensioni sono miscele Solido/Liquido, ad esempio il fango.
Le emulsioni sono miscele Liquido/Liquido, ad esempio il latte o la maionese
I fumi sono miscele Solido/Gas, ad esempio particelle solide disperse in aria
Le nebbie sono miscele Liquido/Gas, ad esempio goccioline di acqua disperse in aria
4. Interpretazione submiscroscopica delle miscele omogenee
Possiamo applicare il modello particellare per cercare di interpretare a livello submicroscopico la natura delle soluzioni.
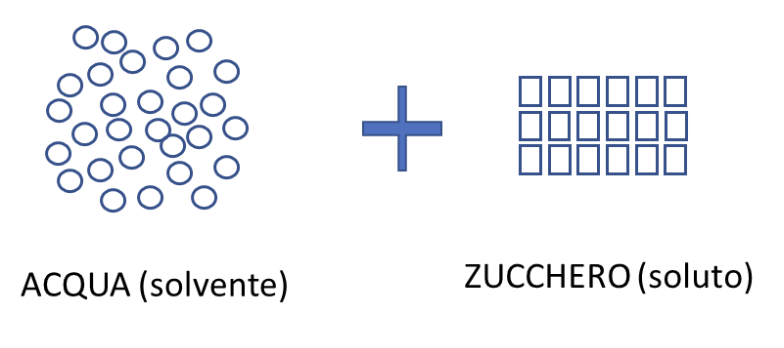
Abbiamo già visto il caso di una miscela di due gas. Consideriamo ora la situazione di un solido (ad esempio lo zucchero) che viene solubilizzato in acqua.
Questa è la rappresentazione della situazione di partenza

In maniera analoga possiamo rappresentare una soluzione di due liquidi, ad esempio acqua e alcool etilico. In questo caso ciò che cambia è la rappresentazione della situazione di partenza, perché abbiamo due liquidi da rappresentare:
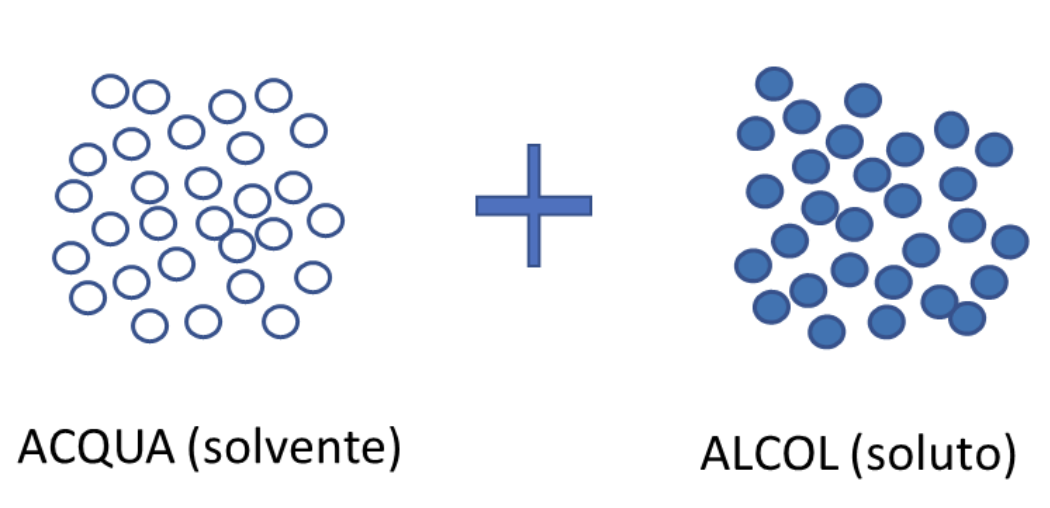
La soluzione sarà rappresentabile in questa maniera:

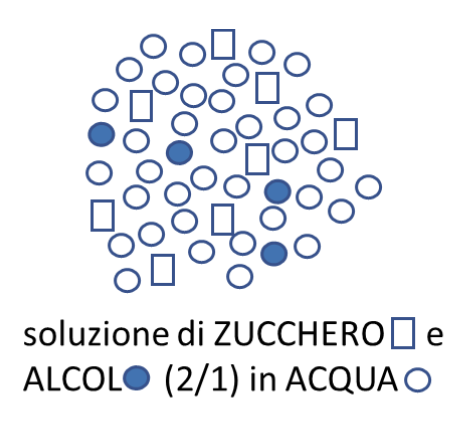
Infine vediamo di rappresentare una situazione nella quale abbiamo una soluzione costituita dal solvente acqua ( ![]() ) e da due soluti: Zucchero (
) e da due soluti: Zucchero ( ![]() ) e Alcol (
) e Alcol ( ![]() ). Inoltre in questa soluzione sappiamo che la quantità di zucchero è doppia rispetto a quella dell’alcol.
). Inoltre in questa soluzione sappiamo che la quantità di zucchero è doppia rispetto a quella dell’alcol.
La rappresentazione della soluzione deve evidenziare gli aspetti sopra indicati. Sarà quindi importante esplicitare l’esistenza di una sola fase, la natura liquida della soluzione e il rapporto tra i soluti:
5. Interpretazione submiscroscopica delle miscele eterogenee
Con il modello particellare possiamo agevolmente rappresentare anche le miscele eterogenee
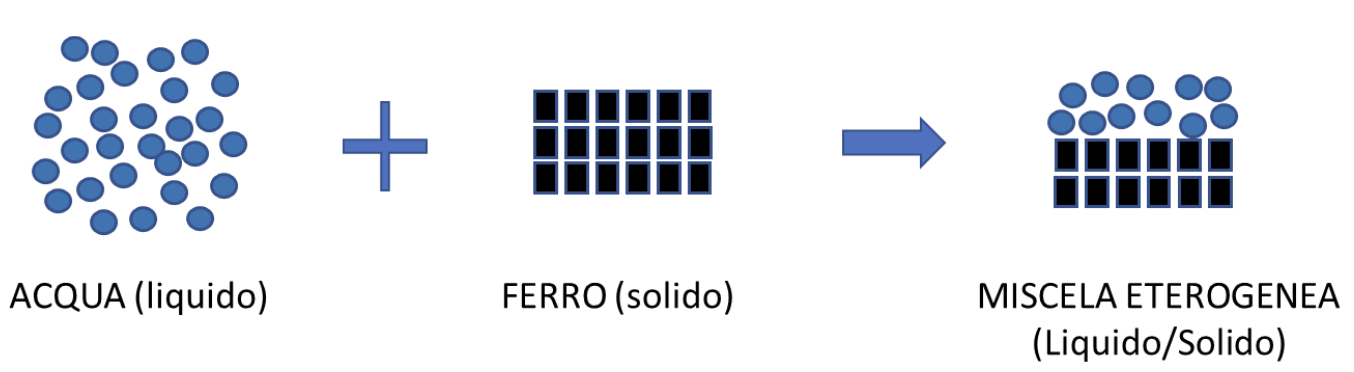
Possiamo considerare una miscela Solido/Liquido di limatura di ferro in acqua. Dovremo avere attenzione a distinguere le due fasi, che avviene anche a livello submicroscopico e a rappresentare correttamente i due diversi stati di aggregazione:
6. Distinguere una miscela da una sostanza pura
Un aspetto che è importante sottolineare è che una miscela, anche se ci appare uniforme, come ad esempio una candela costituita da diverse paraffine, può essere identificata come tale eseguendo una curva di riscaldamento. Infatti, a differenza di quanto visto per le sostanze pure, in una miscela non sono più distinguibile dei punti fissi definiti.
Ad esempio, confrontando la curva di raffreddamento di acido stearico (uno dei componenti delle candele) e della cera di una candela (ricordiamo: miscela solida di vari idrocarburi) si osserva che nella curva della miscela non si osserva più una netta sosta termica, che è invece nettamente individuabile per l’acido stearico, intorno ai 65-67 °C.
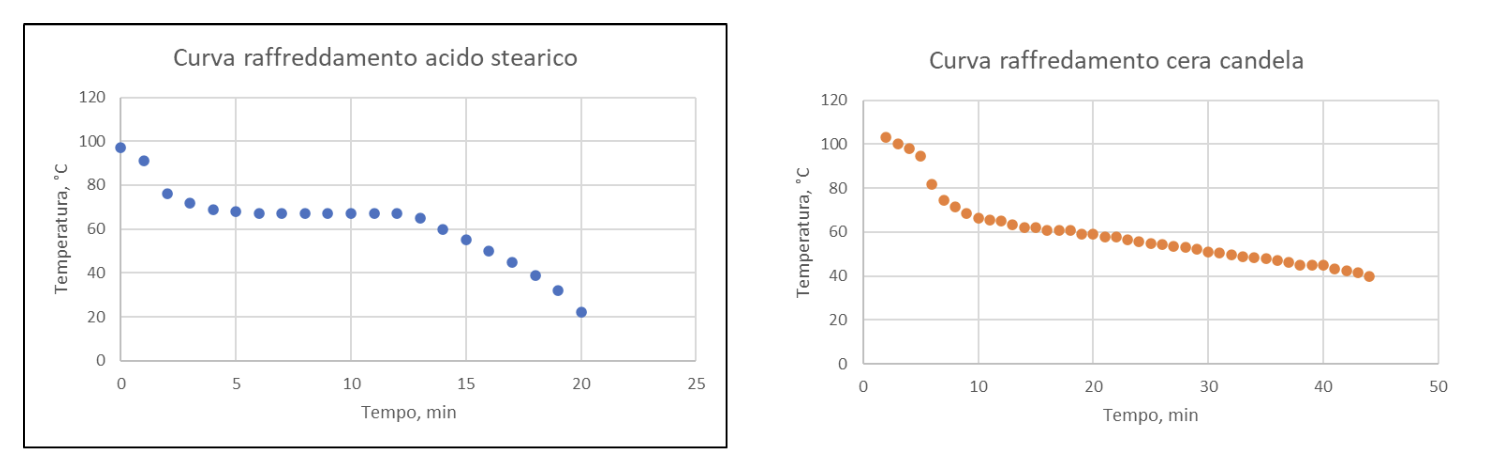
Il motivo di questo comportamento è che ciascuno dei componenti della cera ha un suo punto di fusione caratteristico ma che si confonde con quello degli altri componenti dando come risultato una lenta e costante riduzione di temperatura. Lo stesso fenomeno si può osservare eseguendo una curva di riscaldamento.
7. Separazione di miscele
La formazione di miscele non altera la natura delle sostanze che le costituiscono, questo fa sì che sia in genere praticabile, con semplici metodi di natura fisica, recuperare le sostanze originarie, isolandole dalla miscela nella quale sono presenti.
Sia le miscele omogenee sia quelle eterogenee possono essere separate nei loro componenti. Naturalmente molto dipende dal tipo e dal numero di componenti che costituiscono tali sistemi. Le tecniche più comuni includono la distillazione che sfrutta la diversa temperatura di ebollizione dei componenti liquidi che costituiscono la soluzione e la cristallizzazione, per soluzioni S/L, nella quale si sfrutta la possibilità di riottenere il soluto nella sua forma aggregata solida.
Per miscele eterogenee si può utilizzare la decantazione, la filtrazione e la centrifugazione.
Per miscele omogenee si può utilizzare la cristallizzazione, la distillazione e la cromatografia.
Tutte queste tecniche possono essere messe in opera con apparecchiature moti semplici e in genere facilmente disponibili. Esse però sono di fondamentale importanza in numerosi settori produttivi e di servizio, dove gli stessi principi di base vengono implementati con apparecchiature e strumentazioni notevolmente più sofisticate.
8. Decantazione e filtrazione
Una miscela eterogenea Liquido/Solido può essere separata attraverso una semplice decantazione. Con questa tecnica si lascia semplicemente a riposo per un certo tempo la miscela, consentendo alle particelle più pesanti che costituiscono la fase solida, di depositarsi per gravità sul fondo del contenitore.
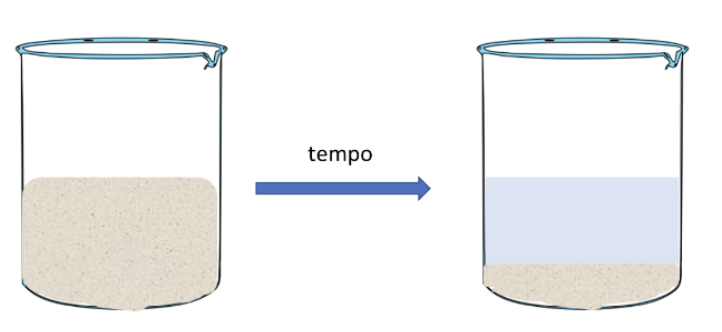
Dopo che il solido si sarà depositato sarà possibile, aiutandosi con una bacchetta di vetro per recuperare la parte liquida denominata surnatante.
Nel caso la sedimentazione del solido sospeso non sia facilmente raggiungibile per semplice decantazione è possibile separare la parte solida dal liquido tramite una filtrazione.
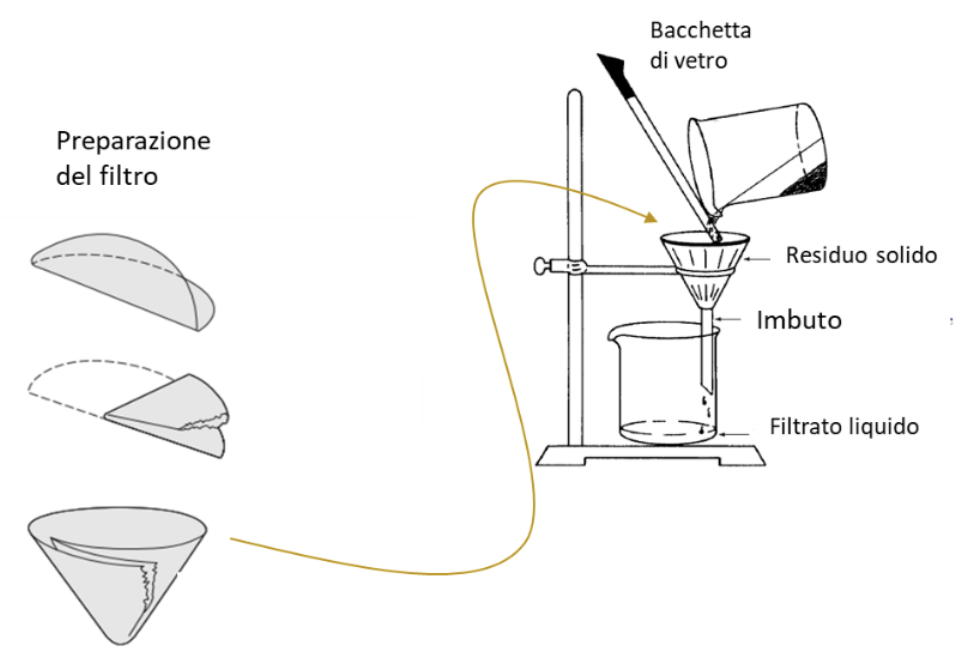
Per filtrazione si intende il processo che porta alla rimozione di una sostanza solida dispersa in un liquido facendo passare la sospensione attraverso un filtro.
In questa tecnica, si trasferisce il liquido su un filtro di opportuna porosità che tratterà le particelle sospese lasciando passare in un contenitore di raccolta solo la parte liquida. Questa operazione può essere effettuata anche sul solo surnatante dopo decantazione, per rendere più completa la separazione delle due fasi.
9. Centrifugazione
Il processo di decantazione di una sospensione solida da una miscela eterogenea può essere facilitato o reso più efficiente, attraverso una centrifugazione. Questa operazione viene in genere condotta con un apparecchio detto centrifuga.
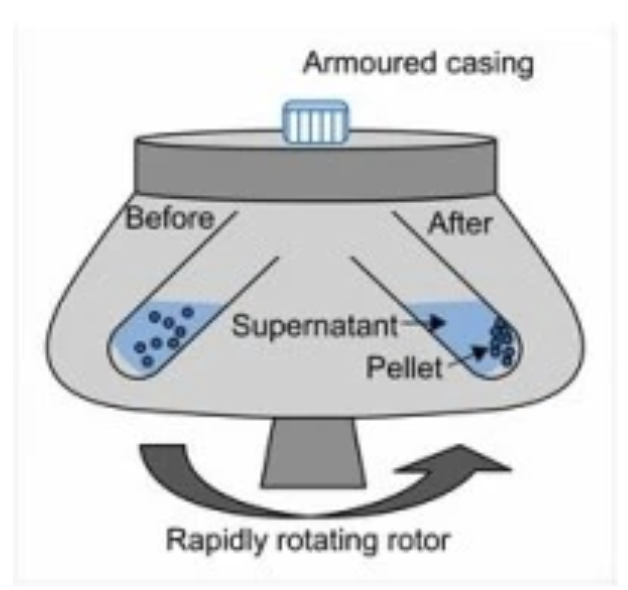
La miscela da separare viene trasferita in appositi tubi da centrifuga. La centrifuga mette in rotazione molto rapida i tubi (migliaia di rotazioni per minuto). L’aumento della forza centrifuga agevola la deposizione verso il fondo dei tubi del materiale solido

Le operazioni successive per isolare le due fasi sono sostanzialmente identiche a quelle descritte in precedenza.
10. Distillazione
La distillazione si applica a soluzioni costituite da soluti aventi diversi punti di ebollizione. Un tipico apparato di distillazione è costituito da un pallone che contiene la soluzione da distillare che viene riscaldato, da un tubo refrigerante, in genere raffreddato con acqua, nel quale il vapore prodotto dal riscaldamento si condensa e da un pallone terminale di raccolta del distillato. È poi importante avere anche un termometro per il controllo della temperatura del vapore.

L’apparato può essere utilizzato per separare dei sali disciolti in acqua (ad esempio acqua di mare o di sorgente). L'acqua ha un punto di ebollizione (Te ≈ 100°C) inferiore rispetto ai solidi disciolti presenti. Il riscaldamento della soluzione al punto di ebollizione provoca il passaggio allo stato vapore dell'acqua. I solidi disciolti, che hanno un punto di ebollizione molto più alto dell'acqua, rimangono in soluzione. Quando il vapore raggiunge il condensatore incontra una zona di temperatura più fredda e torna allo stato liquido che si raccoglie, come sostanza pura nel pallone di raccolta.
Lo stesso processo può essere condotto in una soluzione di acqua e alcol etilico. In questo caso il componente con punto di ebollizione più basso è l’alcol etilico (Te = 78.4°C). quando il vapore raggiunge la Temperatura di ebollizione dell’alcol questo comincerà a passare in fase vapore, mentre l’acqua rimarrà allo stato liquido. Il vapore dell’alcol condenserà nel tubo refrigerato e si potrà isolare nel pallone di raccolta. Appena la temperatura del vapore comincerà a salire si avrà l’indicazione che è iniziato il processo di evaporazione dell’acqua e si potrà interrompere la procedura.
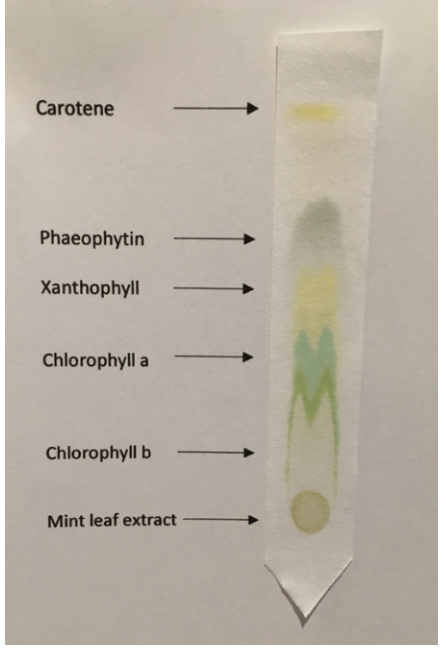
11. Cromatografia
Questa tecnica è sicuramente la più complessa di quelle citate, ma ha il vantaggio di potere essere applicata anche a soluzioni contenenti numerosi composti. La sua versione più semplice è la cromatografia su carta. In tale tecnica si utilizza una striscia di carta da filtro sulla quale viene depositata una piccola quantità di soluzione. L’estremità del supporto viene poi immersa in un solvente.

Il processo di separazione cromatografica si avvia quando il solvente inizia, per capillarità, a risalire lungo la superficie del supporto. In funzione della diversa tendenza a traferirsi nel liquido eluente, i soluti verranno trascinati con velocità diverse, distribuendosi lungo la striscia di carta. La posizione dei diversi soluti ne consente l’identificazione o la loro eventuale raccolta, rimuovendo la superficie sulla quale si sono trasferiti.