Fissaidee 2
| Site: | Federica Web Learning - LMS |
| Course: | Scienze chimiche di base |
| Unit: | Fissaidee 2 |
| Printed by: | Utente ospite |
| Date: | Tuesday, 26 August 2025, 7:01 PM |
Table of contents
- 1. Le trasformazioni fisiche e i passaggi di stato
- 2. I passaggi di stato e i punti fissi
- 3. I passaggi di stato con il modello particellare: da Solido a Liquido
- 4. I passaggi di stato con il modello particellare: da Liquido a Vapore
- 5. La curva di riscaldamento
- 6. La curva di raffreddamento
- 7. Espansione e compressione termica dei gas
- 8. Equivalenza fra temperatura e velocità delle particelle
- 9. Il mescolamento di due volumi uguali di gas
- 10. La dilatazione dei solidi
- 11. Conclusioni
1. Le trasformazioni fisiche e i passaggi di stato
Cosa si intende per trasformazione fisica della materia?

Quando riscaldiamo un pezzo di rame fino a portarlo allo stato liquido abbiamo modificato profondamente lo stato del corpo. Da un corpo rigido dotato di forma e dimensione proprie, abbiamo ottenuto un corpo liquido che non ha forma propria e si adatta al recipiente che lo contiene.
Il fenomeno che porta un corpo dal suo stato solido al suo stato liquido prende il nome di fusione.
Con il rame è pressoché impossibile, ma con molte sostanze allo stato liquido, ad esempio l’acqua o l’alcol etilico, continuando a scaldare il corpo, si giungerà ad una temperatura alla quale esse inizieranno a bollire: questo fenomeno prende il nome di ebollizione. Durante questo processo, progressivamente, parte del corpo liquido passerà allo stato di aeriforme e, se aspettiamo un tempo sufficientemente lungo, tutto il corpo passerà allo stato vapore e non rimarrà nulla nel recipiente che lo conteneva.

Queste trasformazioni fisiche (fusione, ebollizione...) sono fenomeni macroscopici osservabili che si possono agevolmente rappresentare al livello microscopico con il modello particellare. Per farlo conviene riferirsi inizialmente ad un corpo puro che, come detto precedentemente, è costituito di un’unica sostanza.
L’acqua, il rame e l’alcol etilico sono tutti esempi di corpi puri, costituiti tutti da un’unica sostanza e rappresentabili quindi con particelle tutte uguali. Più avanti nella lezione (unit 3) ci occuperemo di corpi costituiti da particelle di diversa natura, ovvero di diverse sostanze (miscele e miscugli).
2. I passaggi di stato e i punti fissi
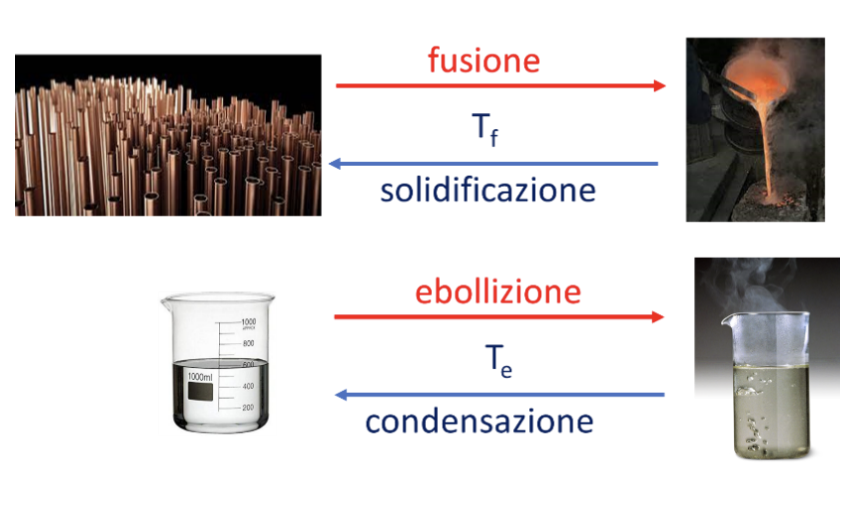
Le sostanze pure possono essere caratterizzate dai loro punti fissi che corrispondono alla temperatura alla quale la sostanza pura passa da uno stato fisico di aggregazione ad un altro.
I punti fissi sono la temperatura di fusione (passaggio da solido a liquido) che corrisponde a quella del passaggio opposto: solidificazione e la temperatura di ebollizione (passaggio da liquido a vapore) che corrisponde a quella del passaggio opposto: condensazione).
Le temperature di ebollizione e di fusione rivestono una particolare importanza, perché sono specifiche di ciascuna sostanza e ne permettono un’accurata identificazione.
Il passaggio dallo stato liquido a quello solido è detto solidificazione ed avviene alla stessa temperatura della fusione. Il passaggio dallo stato vapore a quello liquido è detto condensazione ed avviene alla stessa temperatura della ebollizione.
Infine, vi sono altri due passaggi di stato da citare: la sublimazione e il brinamento che indicano, rispettivamente, il passaggio di stato da solido a vapore e il passaggio opposto senza che avvenga il passaggio nello stato liquido intermedio.
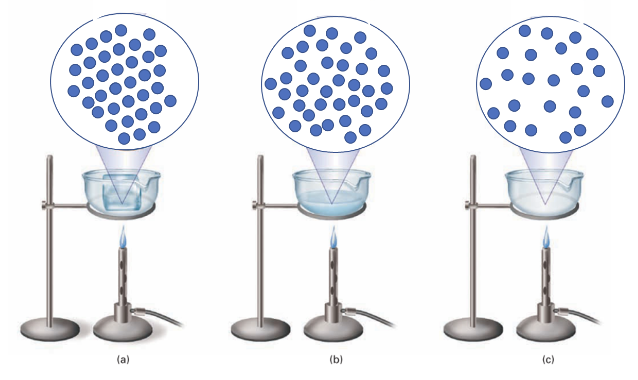
3. I passaggi di stato con il modello particellare: da Solido a Liquido
Prendiamo in considerazione un corpo puro, costituito da una sola sostanza, allo stato solido. A questo corpo iniziamo a somministrare calore. Inizialmente il corpo non manifesterà modifiche osservabili ma, continuando a fornire calore, si osserva che alcune zone del corpo iniziano a passare allo stato liquido. Questa transizione dura un certo periodo di tempo. Durante questo tempo il corpo coesiste in due diversi stati: quello liquido e quello solido. Il sistema si dice che è costituito da due fasi: quella solida e quella liquida. La presenza di due fasi diverse è contraddistinta dalla presenza di una interfaccia visibile a livello macroscopico che le separa e che può essere rappresentata anche a livello microscopico.
Ad un certo punto la fase solida scompare e tutto il corpo è convertito nello stato di aggregazione liquido.

4. I passaggi di stato con il modello particellare: da Liquido a Vapore
Man mano che si procede a somministrare calore nel corpo liquido inizieranno a comparire delle minuscole bollicine che poi cresceranno di numero e dimensione fino a coinvolgere tutto il volume del corpo quando si arriva all’ebollizione. Anche in questo sistema distinguiamo due fasi: quella liquida e quella vapore, racchiusa nelle bolle che si formano nel corpo liquido.

Continuando nella somministrazione di calore si osserva il liquido diminuire di volume fino alla sua scomparsa. In realtà nulla è svanito, semplicemente le particelle che costituivano il corpo sono ora allo stato aeriforme distribuite nel volume nel quale l’esperimento è stato condotto.
A fianco a ciascun passaggio possiamo vedere la rappresentazione con il modello particellare.
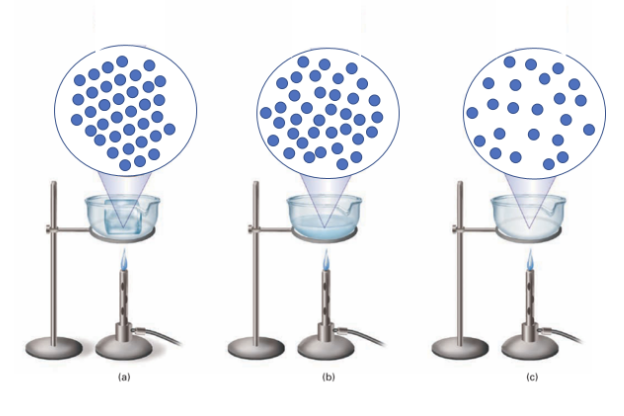
In conclusione, seguendo gli assiomi del modello, il riscaldamento del corpo ha provocato un progressivo allontanamento delle particelle, riducendo progressivamente la forza che le teneva più o meno vincolate nello stato solido e liquido fino ad annullarle nello stato aeriforme.
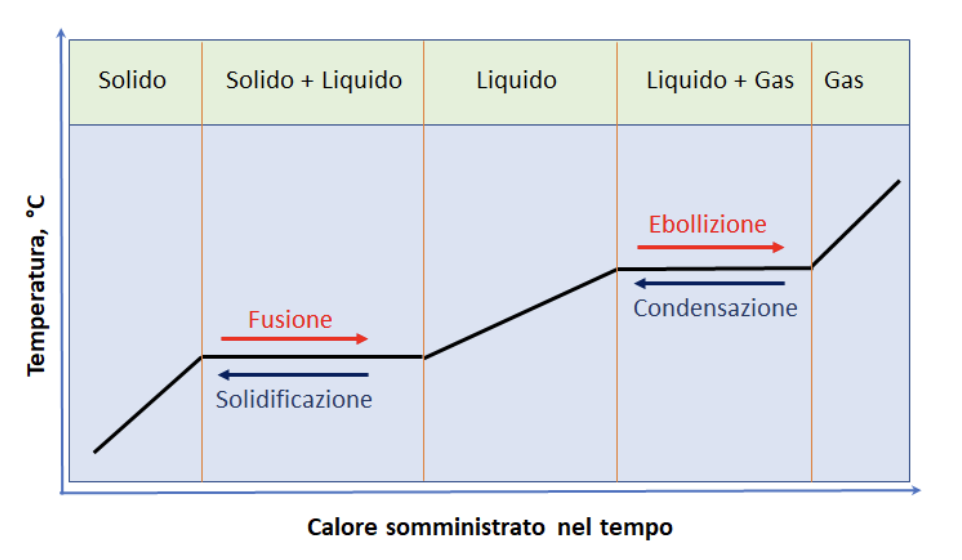
5. La curva di riscaldamento
I passaggi di stato descritti nella slide precedente possono essere seguiti in maniera quantitativa registrando, durante la somministrazione di calore, la variazione della temperatura del sistema nel tempo. Si ottengono così delle rappresentazioni grafiche di particolare interesse che sono dette curve di riscaldamento. In tali curve si individuano in genere tre tratti crescenti e due tratti paralleli all’asse del tempo, che sono dette soste termiche.
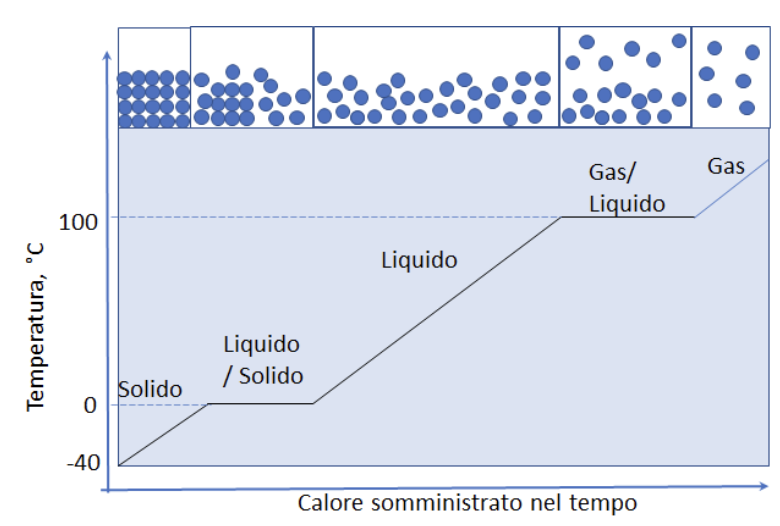
In realtà con apparati semplici non è molto agevole determinare la temperatura della fase gassosa, ma, in genere, si riescono a leggere bene i valori di temperatura delle soste termiche. Il passaggio dal solido al liquido avviene alla temperatura di fusione. Il passaggio dal liquido al vapore avviene alla temperatura di ebollizione. Questi valori sono caratteristici delle sostanze e ne consentano l’identificazione.

6. La curva di raffreddamento
Se eseguiamo lo stesso esperimento “al contrario” ovvero raffreddando (sottraendo calore al sistema) e registrando le temperature del sistema nel corso del tempo, otteniamo un grafico simile al precedente ma che prende il nome di curva di raffreddamento. Se l’esperimento è condotto in modo rigoroso le due curve tendono a sovrapporsi. In particolare, le soste termiche si registrano alle stesse temperature. Tali temperature sono numericamente identiche alle precedenti, anche se identificano processi diversi. Seguendo il raffreddamento del sistema, prima avremo il passaggio dallo stato di aggregazione aeriforme a quello liquido, la condensazione. In questa sosta termica, la temperatura che si registra è identica alla temperatura di ebollizione. Continuando nel raffreddamento si raggiunge la zona nella quale avviene il passaggio dallo stato di aggregazione liquido a quello solido. La temperatura che si registra nella sosta termica di solidificazione del corpo è identica in valore alla temperatura di fusione.
Riassumendo i vari processi e le varie fasi presenti nel sistema durante il processo di riscaldamento e raffreddamento si possono rappresentare in un unico grafico.
7. Espansione e compressione termica dei gas
Sempre utilizzando il modello particellare possiamo interpretare e rappresentare a livello submicroscopico diversi fenomeni osservabili a livello macroscopico relativi ai corpi gassosi.
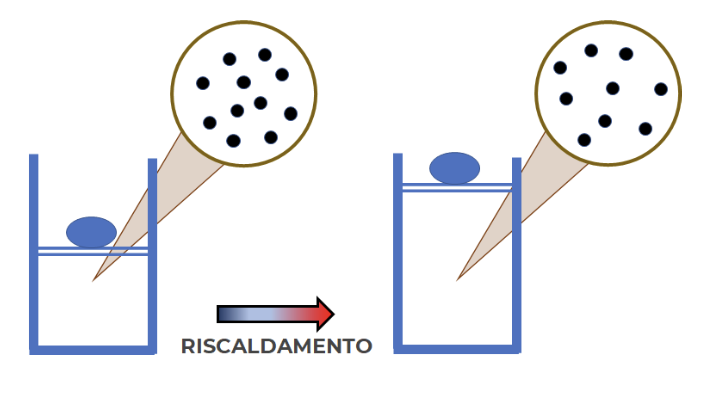
Consideriamo ad esempio la situazione nella quale un corpo puro gassoso è contenuto in un cilindro chiuso con un pistone mobile. Abbiamo già visto (usando una semplice siringa) che esercitando una forza/pressione è possibile comprimere o espandere un corpo gassoso.
Lo stesso fenomeno avviene se l’energia necessaria viene trasferita sotto forma di calore, ovvero se il corpo gassoso viene riscaldato o, viceversa, raffreddato.
Se il gas viene riscaldato, dopo un certo tempo osserveremo il pistone spostarsi verso l’alto. Dato che la quantità di gas è invariata e il numero delle particelle è analogamente rimasto costante dobbiamo concludere che le particelle si sono distanziate le une dalle altre come rappresentato qui:
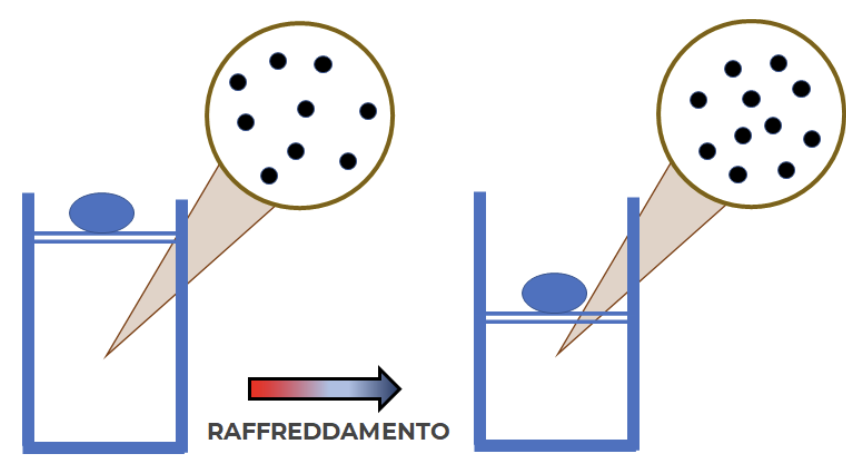
Raffreddando o, semplicemente, rimuovendo la fonte di calore, il pistone tornerà a riportarsi nella posizione originaria una volta raggiunta la temperatura iniziale. Di fatto il raffreddamento ha determinato un fenomeno analogo a quello che abbiamo osservato nella compressione meccanica (la mano che spinge sulla siringa) del gas.
8. Equivalenza fra temperatura e velocità delle particelle
Possiamo chiederci quale sia l’origine della forza che porta il pistone a sollevarsi. Un assioma del modello particellare ci dice che le particelle sono in costante movimento. Esse, quindi, urteranno contro le pareti del cilindro ma anche contro il pistone mobile. Anche all’esterno del pistone ci sono particelle di gas (aria ad esempio) che urtano la superficie. Alla temperatura iniziale il pistone non si muove, e questo ci fa dedurre che il numero degli urti delle particelle dentro al pistone equivalga a quello delle particelle all’esterno. Ad ogni urto delle particelle interne è associata una certa forza che si oppone a quella esercitata dalle particelle all’esterno. Se iniziamo a fornire energia al sistema, trasferendola sotto forma di calore, il pistone comincia a sollevarsi. Richiamando il ragionamento appena fatto, possiamo dedurre che il pistone si sposta verso l’alto perché riceve un numero di urti superiore a quello ricevuto dall’esterno. Dato che il numero di particelle del gas che viene riscaldato è costante ciò significa che oltre ad essersi tra loro allontanate (espansione del corpo) hanno aumentato anche la loro velocità.
A seconda della temperatura la posizione del pistone è diversa:
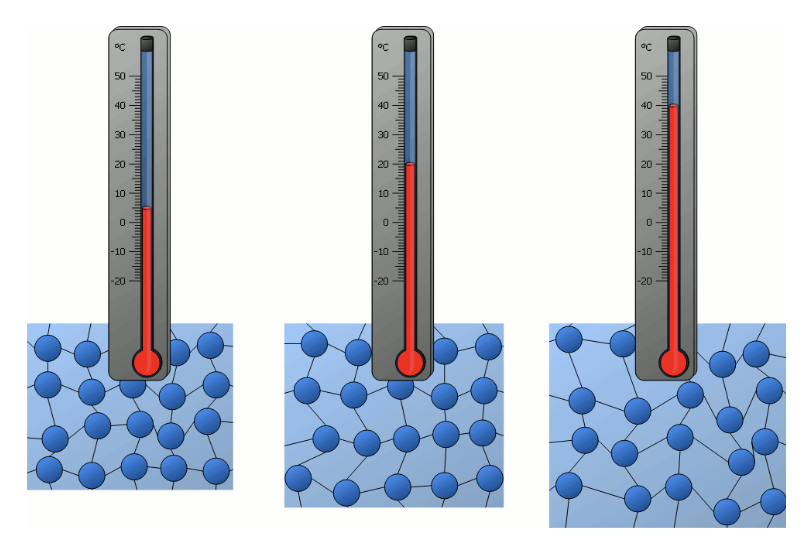
più la temperatura aumenta più il pistone si innalza superando sempre di più la forza esercitata dalle particelle che agiscono su di esso dall’esterno, si può quindi dedurre che la temperatura del gas è collegata al numero di urti e, di conseguenza, alla velocità di spostamento delle particelle che costituiscono il gas.
Se ripensiamo al moto delle particelle di un aeriforme e come questo dipenda dalla temperatura ci rendiamo conto che riducendo la temperatura il moto relativo delle particelle si ridurrà sempre più. Nel corpo liquido le particelle continuano a muoversi in misura molto minore di quanto avviene nel gas. mentre nello stato solido le particelle non si muovono più liberamente, ma presentano solo un moto di vibrazione intorno ad una posizione fissa.
9. Il mescolamento di due volumi uguali di gas
Vediamo ora un’altra situazione. Consideriamo due quantità uguali di un gas colorato che occupano due contenitori di identico volume separati fra loro da una parte rimovibile e con le estremità chiuse da due pistoni mobili:
![]()
Dal punto di vista della rappresentazione con il modello particellare la situazione è questa:
![]()
Se rimuoviamo la parete mobile il gas tenderà ad occupare tutto la spazio a sua disposizione.
![]()
Possiamo rappresentare così la situazione
![]()
Dal punto di vista macroscopico non osserviamo una variazione di colore perché nello stato finale abbiamo un numero doppio di particelle che occupa un volume doppio di spazio. Il rapporto fra numero di particelle e volume è quindi invariato.
Ci possiamo chiedere che cosa può essere successo alla temperatura del corpo. La rappresentazione con il modello particellare ci evidenzia che non vi è né compressione né espansione. Le particelle si trovano quindi tra loro alla stessa distanza media che avevano nei comparti separati e continuano a muoversi alla stessa velocità. La temperatura sarà quindi la stessa.
10. La dilatazione dei solidi
Consideriamo ora un corpo puro solido. Anche in questa situazione le molecole continuano a conservare un lieve moto relativo. Un famoso esperimento (la sfera di Gravesande) permette di osservare l’effetto del riscaldamento su un corpo solido
Nell’esperimento di Gravesande un corpo puro di forma sferica viene fatto passare attraverso un anello di diametro interno identico a quello della sfera.
Successivamente la sfera viene riscaldata e, dopo questa operazione, la sfera non passa più attraverso l’anello.
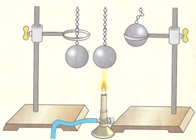
Questo esperimento dimostra che la temperatura determina l’effetto macroscopico della dilatazione del corpo. Il MP ci aiuta a comprendere cosa avviene a livello submicroscopico.
Considerando gli assiomi che prevedono la non deformabilità e la costanza di volume delle particelle, l’unica spiegazione è che il riscaldamento porti ad aumentare la distanza fra le particelle, aumentando lo spazio vuoto che le separa. Possiamo rappresentare in questo modo il sistema prima e dopo il riscaldamento.


Le particelle restano vincolate e molto stipate tra loro ma si distanziano un poco. Il corpo, infatti, rimane nello stato di aggregazione solido.
L’interpretazione della dilatazione del corpo solido è congruente con le riflessioni fin qui fatte sull’effetto della temperatura sullo stato di aggregazione dei corpi e dimostra la versatilità e l’utilità del modello particellare nella comprensione e interpretazione di numerosi fenomeni che coinvolgono i corpi e le loro trasformazioni fisiche
11. Conclusioni
Tutti i passaggi di stato visti in precedenza si definiscono trasformazioni fisiche. In esse ciò che cambia è lo stato fisico della materia: in un passaggio di stato che coinvolge una sostanza, la sostanza di partenza non cambia. La si ritrova identica alla fine del processo. Una certa quantità di acqua che passa da solido, a liquido, a vapore mantiene inalterate le sue caratteristiche anche quando dallo stato vapore ritorna allo stato solido. Questo aspetto è quello che distinguerà, come si vedrà più avanti, le trasformazioni fisiche da quelle chimiche.
Il modello particellare consente di interpretare le diverse trasformazioni fisiche che coinvolgono un corpo puro, ovvero costituito da una sola sostanza.
Nella prossima Unit 3 affronteremo la situazione in cui il sistema osservato è costituito da più di una sostanza.