Fissaidee 3
| Sito: | Federica Web Learning - LMS |
| Corso: | Scienze chimiche di base |
| Unit: | Fissaidee 3 |
| Stampato da: | Utente ospite |
| Data: | martedì, 26 agosto 2025, 21:49 |
1. Nomenclatura dei composti organici
Per evitare di dover memorizzare il nome di migliaia di composti organici o di unità strutturali sono state stabilite delle regole che determinano il nome di ogni composto sulla base della sua struttura e allo stesso tempo rendono possibile dedurre la struttura di un composto dal suo nome. Sulla base di queste regole, stabilite dalla IUPAC: International Union of Pure and Applied Chemistry, nel nome di un composto organico troviamo le parti riassunte nello schema

I composti organici possono essere raggruppati in famiglie che presentano lo stesso gruppo funzionale, con questo termine si intende: «un atomo, o gruppi di atomi o legami specifici all’interno di una molecola, che determinano il comportamento chimico della molecola, indipendentemente dalle dimensioni della molecola».
Una volta riconosciuto nel composto considerato il gruppo funzionale a priorità più alta, secondo quanto stabilito dalla IUPAC (nell’immagine sono indicati quelli citati in questa lezione)
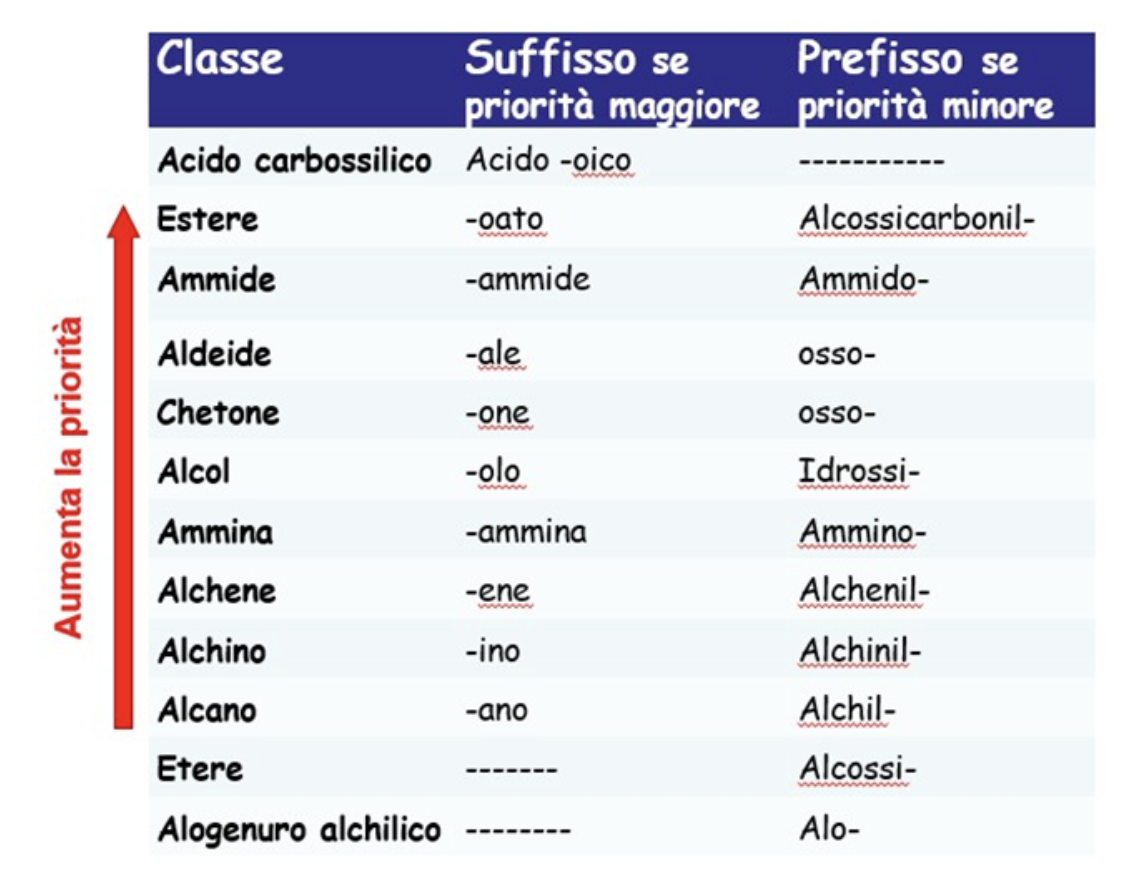
Ad oggi è ancora molto frequente utilizzare la cosiddetta nomenclatura comune, che utilizza nomi d’uso, che hanno origine storica, spesso in relazione all’uso o al materiale da cui è stato isolato il composto e di cui vedremo qualche esempio in seguito.
2. Isomeri costituzionali o strutturali
Sono composti che hanno la stessa formula molecolare o formula bruta, ma differiscono nel modo in cui gli atomi sono legati tra di loro, quindi hanno diversa formula di struttura. Gli isomeri costituzionali contengono gli stessi atomi e in numero uguale, ma gli atomi sono legati gli uni agli altri in modo differente. Per gli alcani all’aumentare dei carboni nella formula bruta aumenta il numero degli isomeri possibili. Utilizzare le regole della nomenclatura IUPAC consente di distinguerli. Ad esempio nella figura sono riportati i 5 possibili isomeri aventi formula bruta C6H14.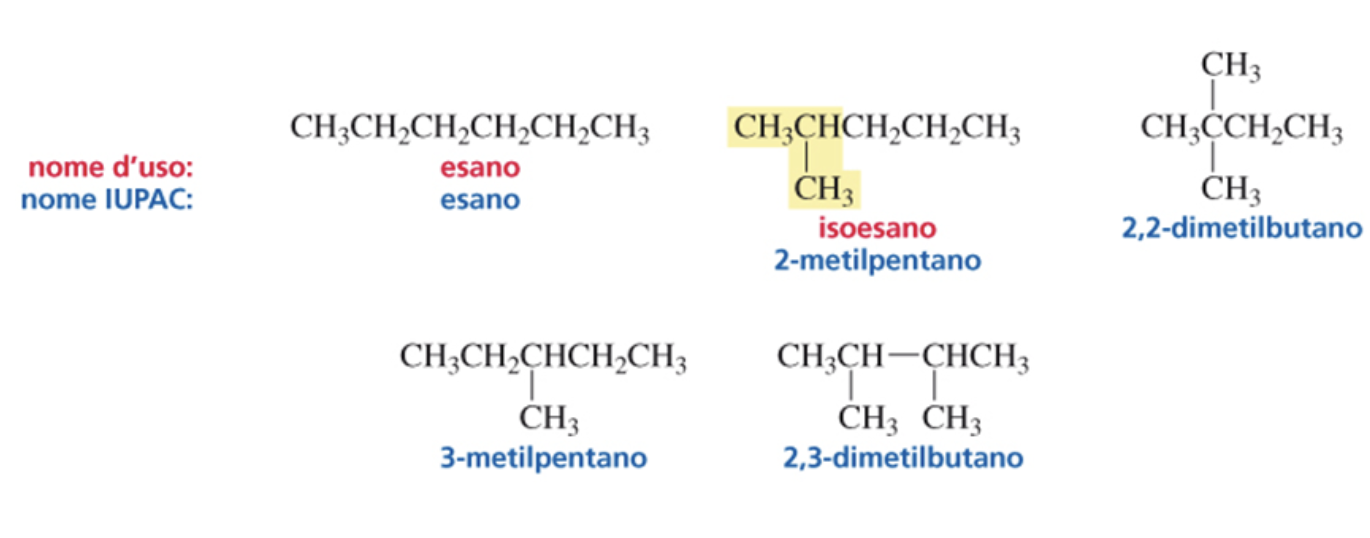
In alcuni casi la differenza nella struttura (cioè nel modo in cui gli atomi sono legati) ha conseguenze molto importanti nelle proprietà, tali che i due isomeri appartengono a due classi chimiche diverse.
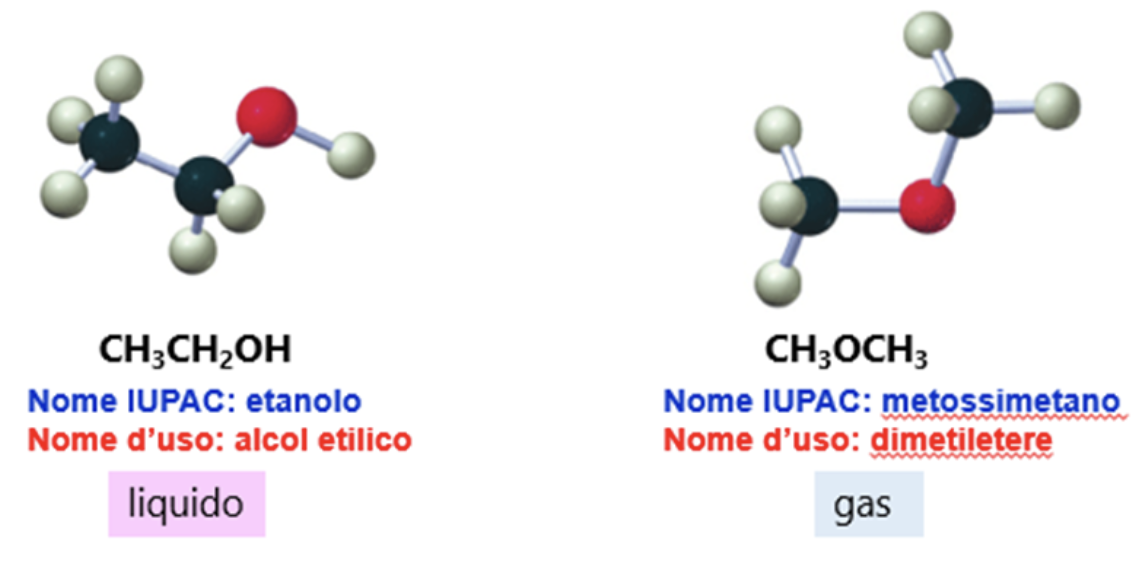
L’etanolo (o alcol etilico) e il metossimetano (o dimetiletere) sono entrambi costituiti da 2 atomi di C, 6 di idrogeno e 1 di ossigeno, quindi hanno formula molecolare C2H6O e peso molecolare 46.
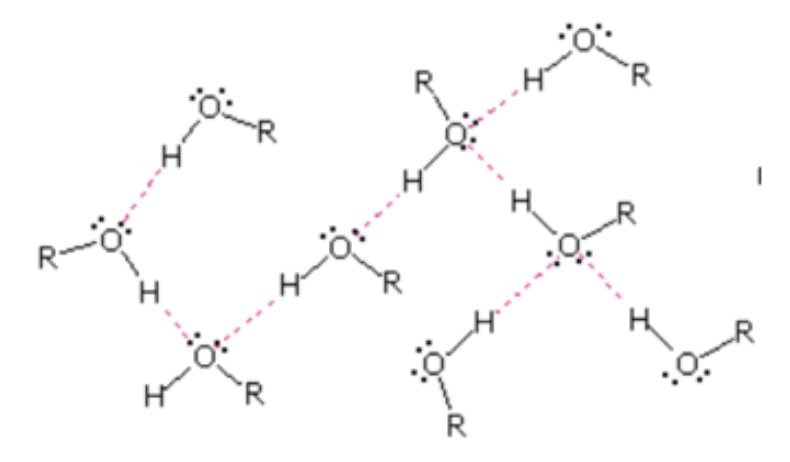
L’etanolo è un liquido che bolle a 78°C (allo stato liquido la presenza del gruppo OH fa sì che si creino legami idrogeno intermolecolari) e presenta la caratteristica discreta reattività degli alcoli.
Il metossimetano è un gas con punto di ebollizione a -24°C e presenta la caratteristica scarsa reattività degli eteri.
Si tratta di due isomeri strutturali e le loro differenze nelle proprietà chimiche e fisiche possono essere spiegate proprio in base alla diversità della loro struttura.
3. Alcoli
Sono composti organici di formula generale R-OH, dove R è una catena carboniosa e il gruppo –OH o idrossile rappresenta l’elemento caratterizzante.
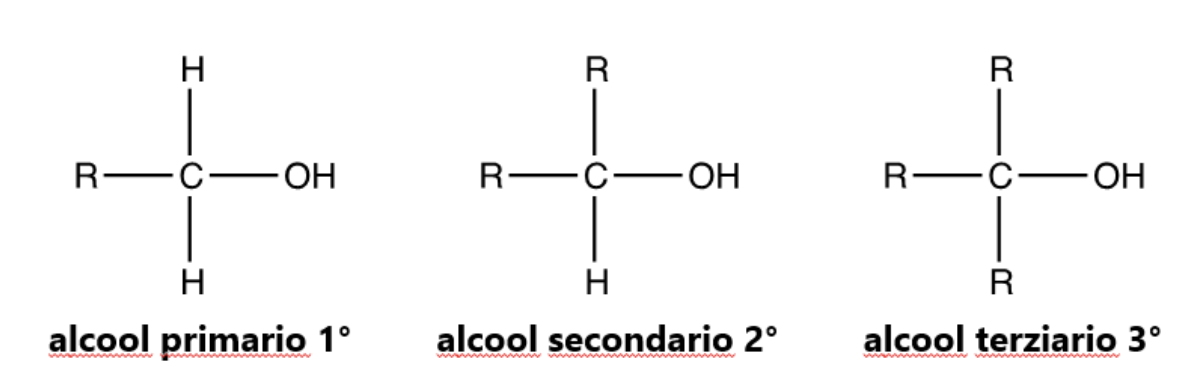
Un atomo di C è primario, secondario e terziario a seconda del numero di atomi di C a cui è legato, analogamente gli alcoli si distinguono in primari, secondari e terziari a seconda dell’atomo di carbonio cui è legato il gruppo –OH,
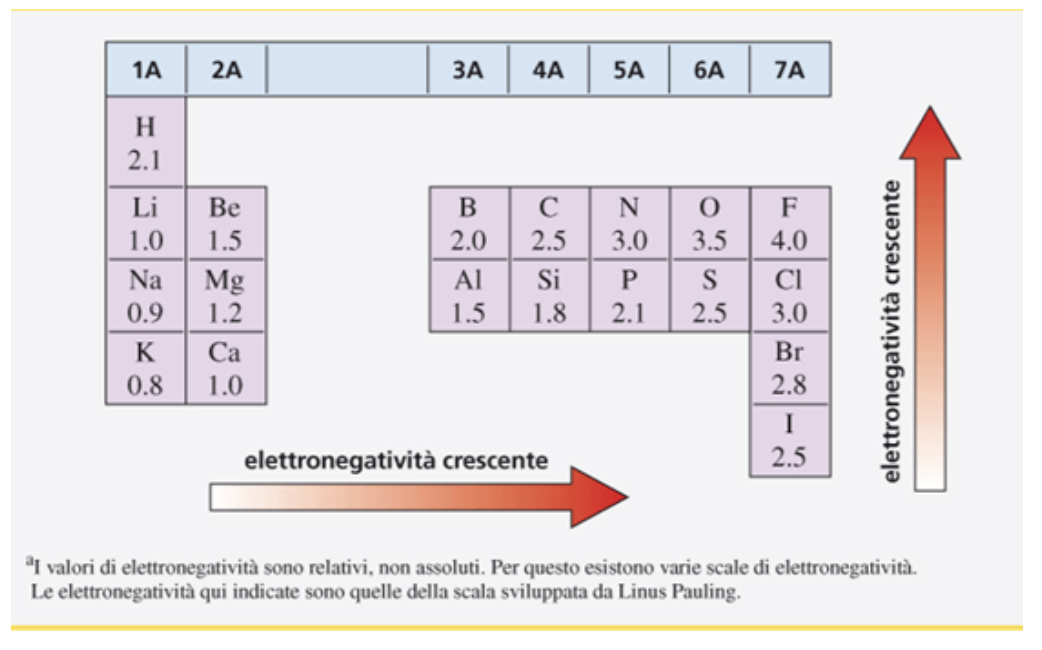
Il gruppo –OH rende gli alcoli composti polari poiché l’ossigeno è più elettronegativo sia del carbonio che dell’idrogeno (nella figura sono riportati i valori di elettronegatività per alcuni degli elementi più comuni) e quindi si ha una parziale carica positiva su quest’ultimo mentre sull’ossigeno una parziale carica negativa.
4. Alcoli: nomenclatura e usi
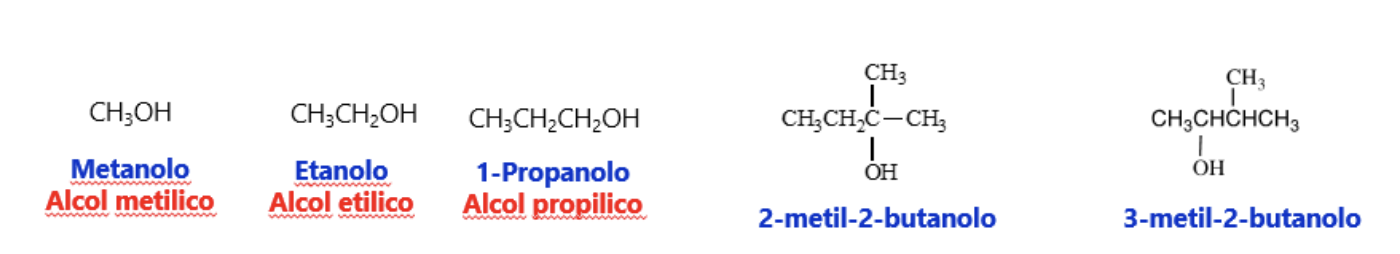
La nomenclatura degli alcoli segue le regole del sistema IUPAC (in blu nello schema). La struttura base viene indicata sostituendo alla desinenza –o dell’alcano il suffisso –olo (es. metanolo). In catene carboniose superiori ai 2 carboni viene specificata la posizione del gruppo OH lungo la catena e la posizione di eventuali altri sostituenti lungo la catena.
I nomi comuni degli alcoli (in rosso nello schema) si ottengono invece aggiungendo come aggettivo alla parola alcol, il nome del residuo alchilico legato al gruppo –OH (es. alcol metilico).
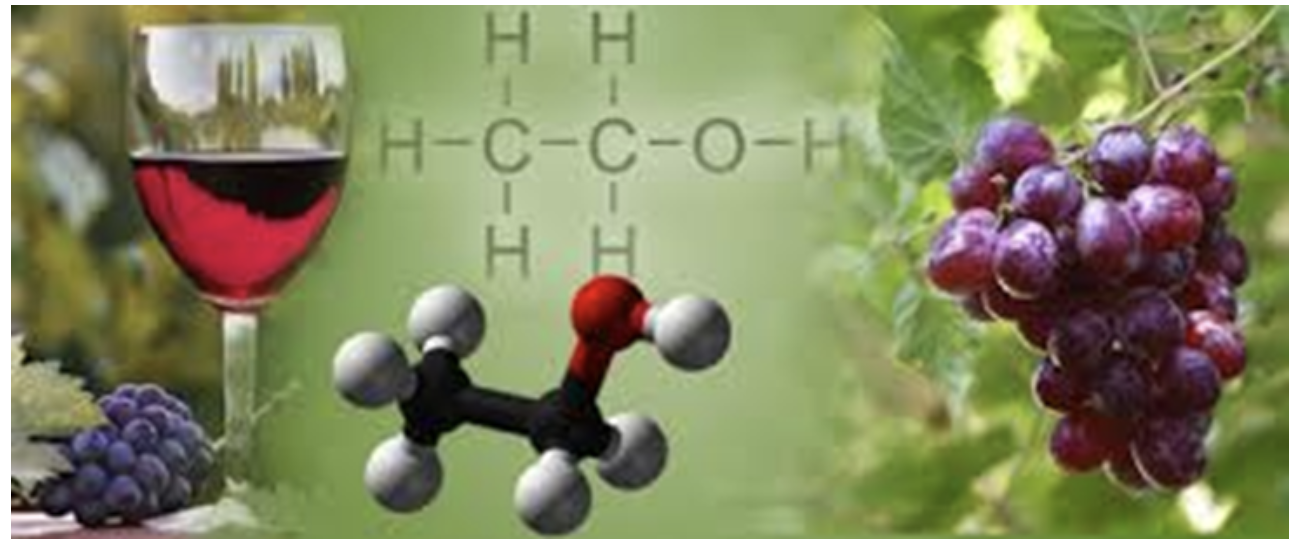
Gli alcoli più semplici sono ampiamente utilizzati come solventi, additivi alimentari, carburanti alternativi e intermedi in innumerevoli processi sintetici. L’etanolo, ottenuto dalla fermentazione alcolica della buccia dell’uva, è presente in percentuali differenti nelle bevande alcoliche e superalcoliche.
5. Aldeidi e chetoni
Sia le aldeidi che i chetoni contengono il gruppo carbonilico polare: gli elettroni del doppio legame carbonilico uniscono due atomi di elettronegatività molto diversa, carbonio e ossigeno, e quindi non sono ugualmente distribuiti. Infatti, la nube elettronica mobile 𝜋 sarà più attratta dall’atomo più elettronegativo, quindi dall’ossigeno.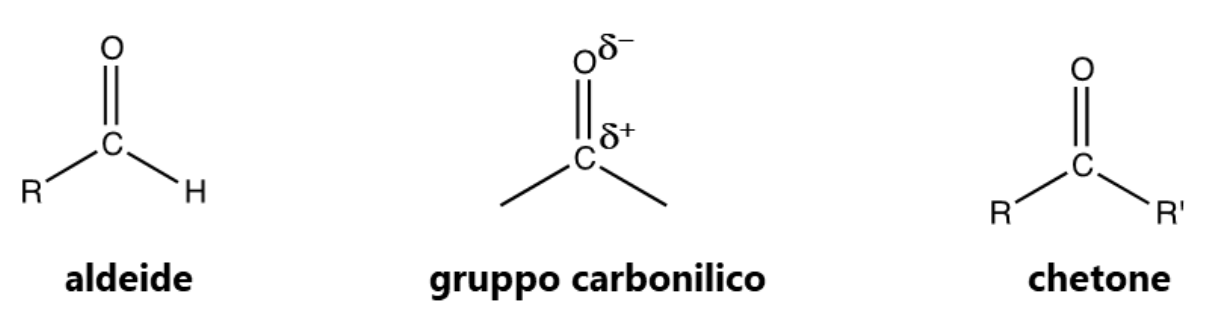
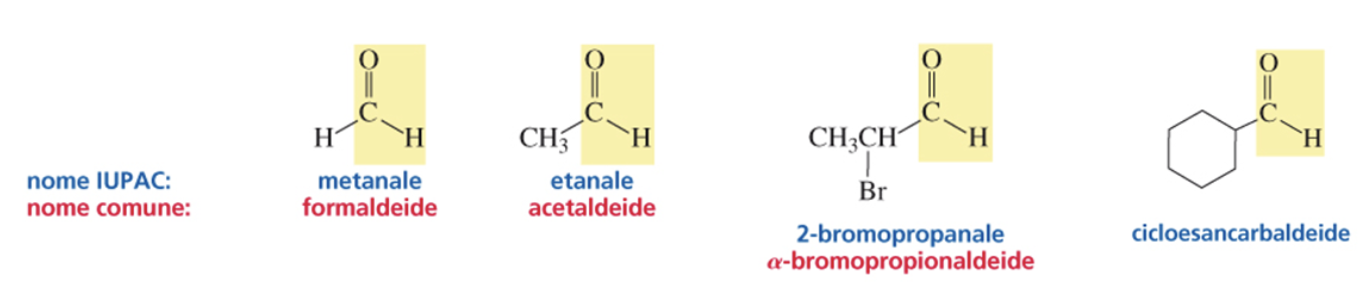
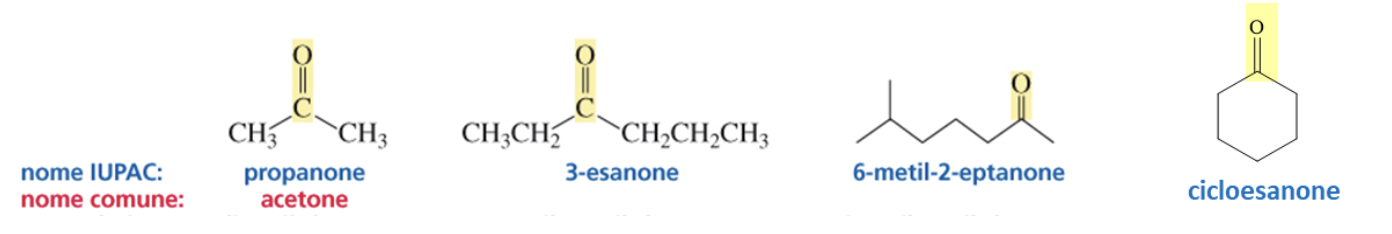
Il gruppo funzionale dei chetoni è rappresentato da un carbonile legato a due gruppi R e R’ ( RC(=O)R’), per indicarne la presenza si sostituisce alla desinenza –o dell’alcano con –one. Nelle catene carboniose con più di 4 carboni ne va indicata la posizione.
Nei chetoni ciclici il carbonio carbonilico assume sempre la posizione 1.
6. Aldeidi e chetoni: aromi e sapori
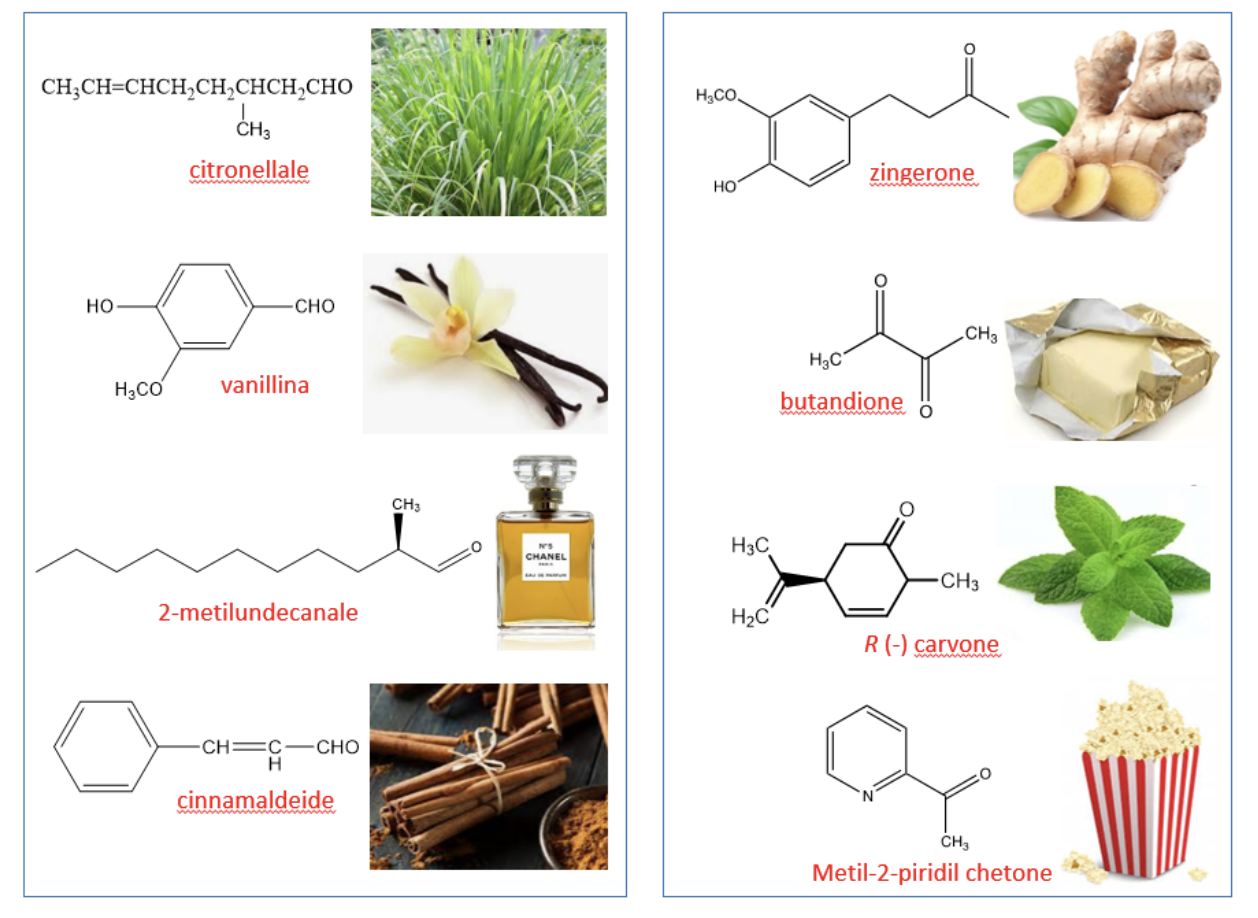
Nella vita di tutti i giorni veniamo frequentemente in contatto con sostanze che devono i loro aromi o fragranze ad aldeidi. Ad esempio nella figura sono riportate alcune di queste sostanze: la cinnamaldeide, che viene estratta dalla corteccia della pianta della cannella ed è il componente attivo di tale spezia; la citronellale, isolata dalla pianta di citronella, e responsabile del caratteristico odore di limone; la vanillina, che è l’agente aromatizzante isolato dai baccelli di vaniglia; il 2-metil-undecanale, uno dei componenti sintetici introdotto da Coco Chanel nel 1921 nel suo Chanel N° 5, considerato tra i principali responsabili della persistenza di questo inimitabile profumo.
Ancora, molti sapori e odori che ci sono familiari devono attribuirsi alla presenza di molecole di tipo chetonico, nella figura sono riportati alcuni esempi: lo zingerone, il componente piccante dello zenzero; il butandione, che conferisce l’aroma caratteristico al burro, l’(R)-(-)Carvone, uno dei componenti principali dell’olio di menta verde; infine il metil-2-piridil chetone, responsabile dell’odore dei popcorn scoppiati.
7. Acidi carbossilici
Sono composti organici di formula generale RCOOH dove R può essere alifatico o aromatico. Il gruppo carbossilico (-COOH) che li caratterizza, è così chiamato poiché deriva dalla fusione tra un gruppo carbonile (C=O) e un gruppo idrossile (OH).
In particolare, l’atomo di carbonio (C) è legato con un doppio legame ad un atomo di ossigeno (O) e con un legame singolo a un gruppo idrossile.
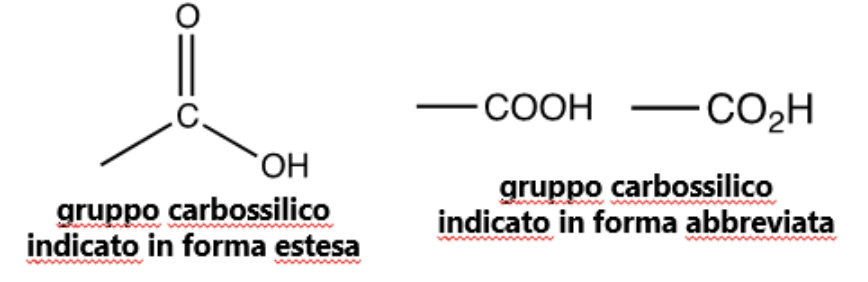
Nella nomenclatura IUPAC il nome di un acido carbossilico si ottiene prendendo come base il nome dell’alcano corrispondente, premettendo il termine “acido”, e sostituendo la desinenza –o con –oico. Il carbonio carbossilico occupa sempre la posizione 1 nelle catene carboniose.
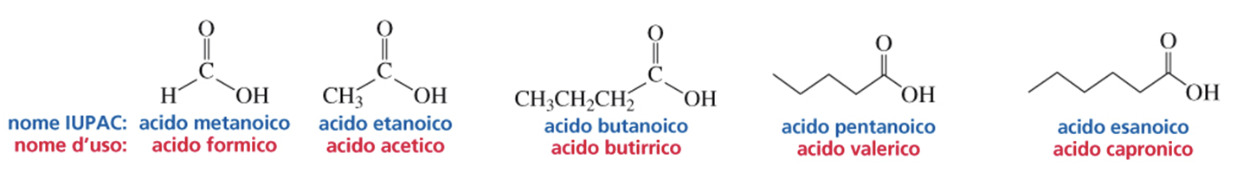
Gli acidi carbossilici alifatici sono noti da molto tempo e alcuni hanno nomi correnti che si riferiscono alla loro origine naturale, piuttosto che alla loro struttura chimica. Ne sono esempi, l’acido formico che è un componente del veleno della formica; l’acido acetico contenuto nell’aceto; l’acido butirrico nel burro rancido; l’acido valerico nella valeriana e l’acido capronico nel latte delle capre.
8. Derivati degli acidi carbossilici
Esistono diversi composti, considerati derivati degli acidi carbossilici, in cui il gruppo –OH legato al carbonio carbonilico viene sostituito con altri atomi o gruppi di atomi, più elettronegativi del carbonio, tra questi derivati ricordiamo i più diffusi in natura e importanti dal punto di vista biologico: gli esteri, e le ammidi.
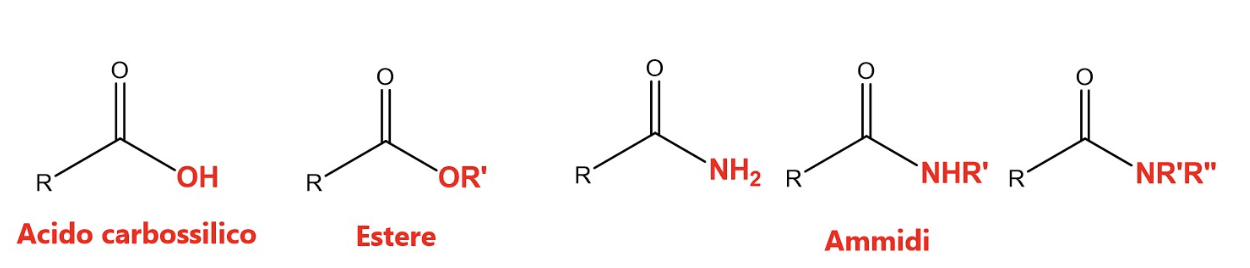
Negli esteri il gruppo idrossilico (-OH) viene sostituito con un gruppo alcossilico (indicato genericamente con -OR’). Nella nomenclatura IUPAC viene mantenuta la radice dell’acido di provenienza sostituendo il suffisso “ico” con “ato” e viene indicato il gruppo alchilico R’ legato all’ossigeno alcossilico (-OR’) facendolo precedere dalla preposizione “di”. Nella figura sono ad esempio riportati due esteri derivanti dall’acido butanoico.
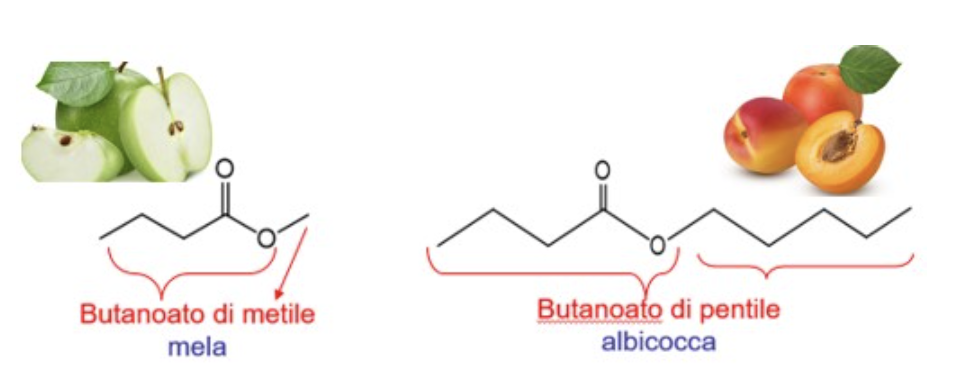
Da notare che gli esteri sono sostanze particolarmente odorose, dal profumo tipicamente fruttato (allo scopo abbondantemente utilizzati nell’industria alimentare e cosmetica), ad esempio il butanoato di metile odora di mela, mentre basta variare la catena alchilica R’ a pentile e ottenere una sostanza che presenta il tipico odore di albicocca (butanoato di pentile).
Nelle ammidi il gruppo idrossilico (-OH) viene sostituito con un gruppo amminico (NH2, per l’ammide primaria, NHR’, per l’ammide secondaria, NR’R” per l’ammide terziaria). Nella nomenclatura IUPAC viene mantenuta la radice dell’acido di provenienza sostituendo il suffisso “oico” con “ammide” e viene indicata la presenza di eventuali gruppi alchilici (R’, R”) legati all’azoto facendoli precedere dalla lettera “N”. Nella figura sono ad esempio riportate tre ammidi derivanti dall’acido butanoico.
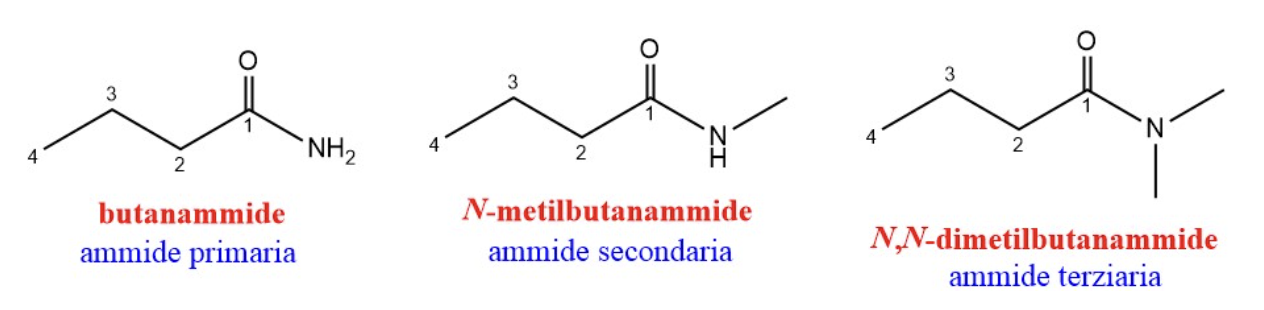
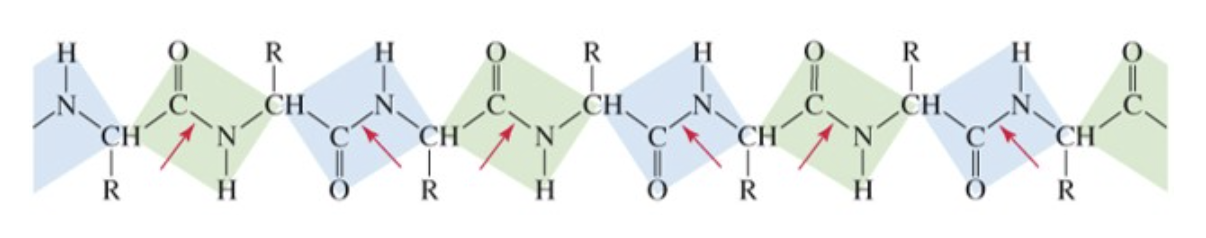
Le ammidi sono composti molto stabili (meno reattive ad esempio degli esteri). Il legame ammidico risulta particolarmente forte, per questo motivo è stato scelto in natura per legare tra loro gli amminoacidi a formare le catene peptidiche delle proteine, prendendo in questo caso il nome di legame peptidico.
9. Ammine
Sono composti che possono essere considerati formalmente derivati organici dell’ammoniaca NH3. A seconda del numero di atomi di idrogeno (uno, due o tre) di quest’ultima che vengono sostituiti con gruppi R, le ammine vengono classificate come primarie, secondarie o terziarie. Nelle ammine si sostituisce la desinenza –o dell’alcano con –ammina. Il nome dei sostituenti legati all’azoto è preceduto da un N corsivo per indicare che il gruppo è legato ad un azoto e non ad un carbonio.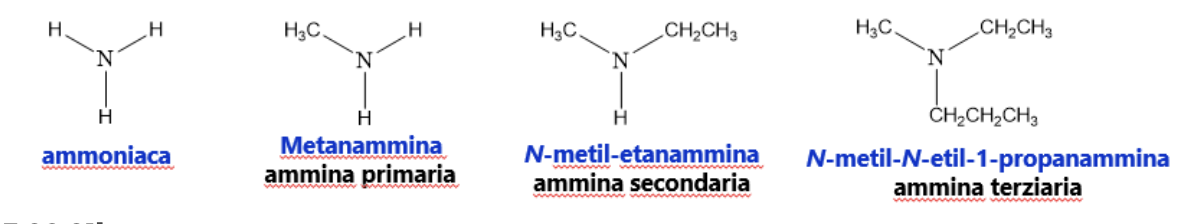
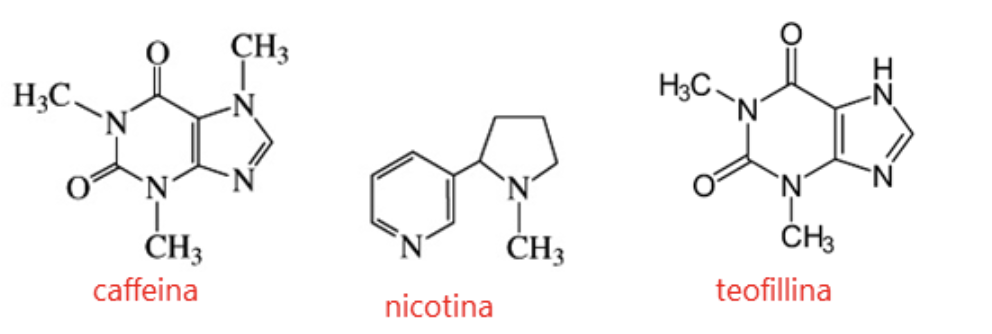
Inoltre, sono eterocicli azotati anche altri composti noti per il loro potere stimolante sul sistema nervoso centrale, come la caffeina, usata anche come coadiuvante analgesico, e la nicotina, il cui utilizzo dà dipendenza e assuefazione; la teofillina, tossica già a basse dosi, utilizzata per le sue proprietà antiasmatiche.
10. Amminoacidi
Gli amminoacidi contengono due gruppi funzionali: uno amminico (-NH2) e uno carbossilico (-COOH). In natura troviamo L-𝛼-amminoacidi, in cui il gruppo amminico è legato al carbonio cosiddetto in alfa (cioè adiacente) al gruppo funzionale, cioè al gruppo carbossilico, L, perché quando vengono scritti, utilizzando la proiezione di Fischer in cui si mette il carbonio in alfa al centro della croce, per consuetudine si mette il gruppo amminico a sinistra (L, dal latino laevus, sinistro). I 20 amminoacidi naturali che costituiscono le catene peptidiche differiscono per il sostituente R, o catena laterale, legato al carbonio 𝛼: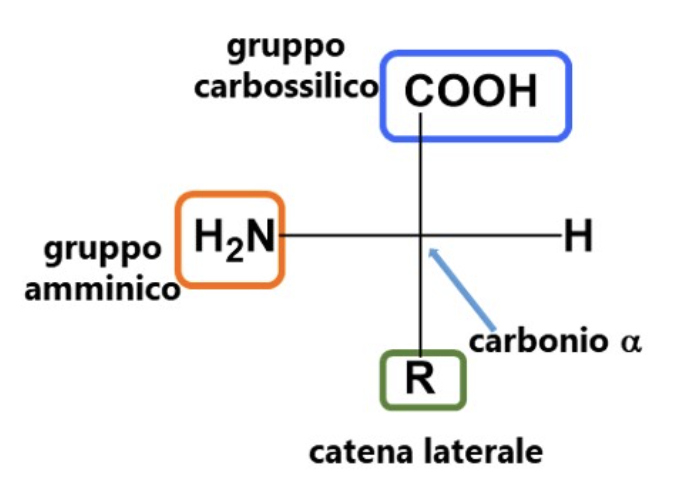
Gli aminoacidi naturali sono chiamati con i loro nomi comuni, che spesso danno informazioni sulle loro caratteristiche e/o origini, ad esempio glicina dal suo sapore dolce (glicos in greco significa dolce), asparagina poiché è stata trovata negli asparagi.
Per velocizzarne la nomenclatura, in particolar modo quando si devono indicare delle sequenze amminoacidiche, per ogni amminoacido esiste un’abbreviazione sia di tre lettere (le prime tre del nome inglese) che di una lettera.

Tutti i 20 amminoacidi sono necessari alla sintesi delle proteine. L’organismo umano è capace di sintetizzarne 10, gli altri 10 (detti essenziali e indicati con *) devono essere assunti con la dieta.
Gli aminoacidi essenziali sono tutti contemporaneamente presenti nelle proteine di origine animale, mentre nelle proteine di origine vegetale si riscontra sempre la mancanza di alcuni di essi: per esempio, le proteine presenti nei fagioli e nei piselli sono carenti di metionina, mentre quelle del mais mancano di lisina e triptofano.