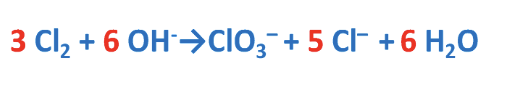Fissaidee 3
| Site: | Federica Web Learning - LMS |
| Course: | Scienze chimiche di base |
| Unit: | Fissaidee 3 |
| Printed by: | Guest user |
| Date: | Tuesday, 26 August 2025, 9:25 PM |
Table of contents
- 1. Schema bilanciamento delle reazioni Red-Ox con il metodo delle semi-reazioni
- 2. Esempio bilanciamento reazioni Red-Ox /1
- 3. Esempio bilanciamento reazioni Red-Ox /2
- 4. Esempio bilanciamento reazioni Red-Ox /3
- 5. Esempio bilanciamento reazioni Red-Ox
- 6. Esempio bilanciamento reazioni Red-Ox /3
- 7. Esempio bilanciamento reazioni Red-Ox in ambiente basico /1
- 8. Esempio bilanciamento reazioni Red-Ox in ambiente basico /2
- 9. Esempio reazione di dismutazione
1. Schema bilanciamento delle reazioni Red-Ox con il metodo delle semi-reazioni
- Step 1. Se necessario scrivere le reazioni in forma ionica ed eliminare gli ioni spettatori;
- Step 2. Assegnare i numeri di ossidazione a tutti gli atomi;
- Step 3. Scrivere le semi-reazioni di ossidazione e di riduzione comprensive del numero di elettroni ceduti e acquistati;
- Step 4. Bilanciare le due semi-reazioni in termini di massa e carica;
- Step 5. Bilanciare il numero di elettroni acquistati e ceduti moltiplicando una o entrambe le semi-reazioni per un numero intero appropriato;
- Step 6. Sommare le semi-reazioni e semplificare le specie presenti da entrambi i lati;
- Step 7. Riscrivere la reazione in forma ionica introducendo gli ioni spettatori.
2. Esempio bilanciamento reazioni Red-Ox /1
Metodo delle semi-reazioni forma molecolare

Step 1. Scrivere le reazioni in forma ionica ed eliminare gli ioni spettatori
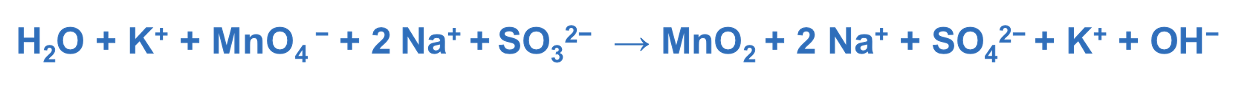
Step 2. Assegnare i numeri di ossidazione
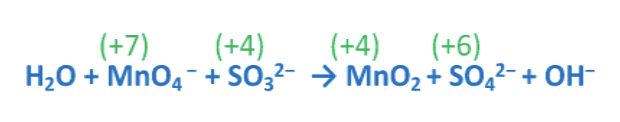
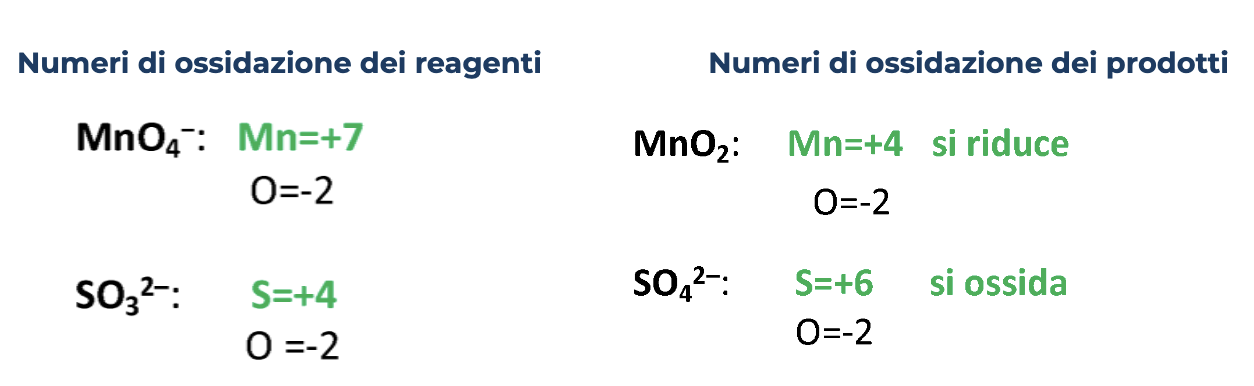
3. Esempio bilanciamento reazioni Red-Ox /2
Step 3. Scrivere le semi-reazioni di ossidazione e di riduzione comprensive del numero di elettroni ceduti e acquistati.

Step 4. Bilanciare le due semi-reazioni in termini di massa e carica
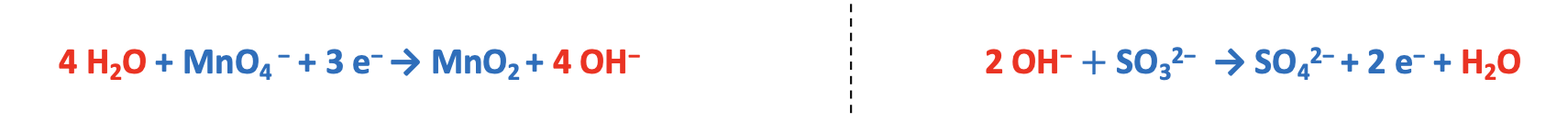
Step 5. Bilanciare il numero di elettroni acquistati e ceduti moltiplicando entrambe le semi-reazioni per un numero intero appropriato. Quest’ultimo viene determinato facendo il minimo comune multiplo. Nel caso specifico esso è 6 e quindi la semi-reazione di riduzione va moltiplicata per 2 mentre quella di ossidazione va moltiplicata per 3.

4. Esempio bilanciamento reazioni Red-Ox /3
Step 6. Sommare le semi-reazioni e semplificare le specie presenti da entrambi i lati.
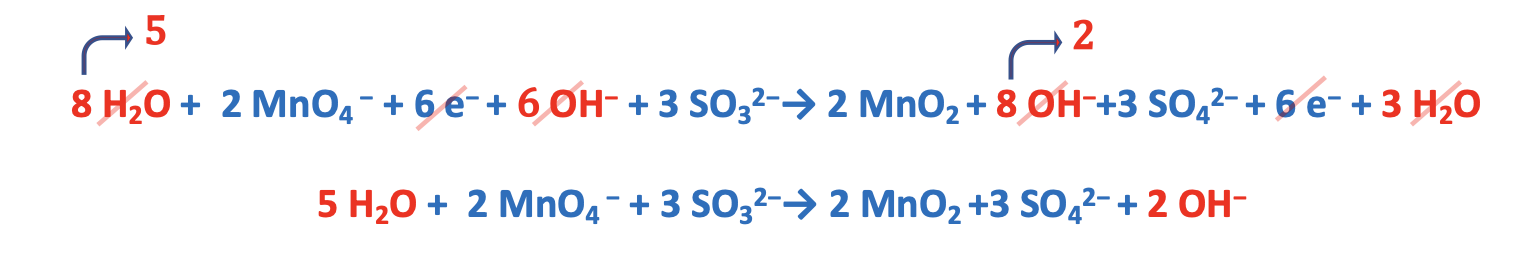
Step 7. Riscrivere la reazione in forma molecolare introducendo gli ioni spettatori eliminati.
5. Esempio bilanciamento reazioni Red-Ox
Metodo delle semi-reazioni forma ionica ambiente acido
Step 1. Assegnare i numeri di ossidazione.
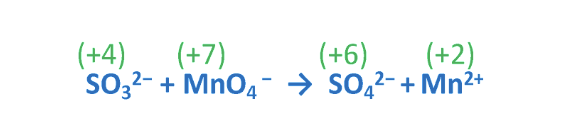

Step 2. Scrivere le semi-reazioni di ossidazione e di riduzione comprensive del numero di elettroni ceduti e acquistati.

6. Esempio bilanciamento reazioni Red-Ox /3
Step 3. Bilanciare le due semi-reazioni in termini di massa e carica.

Step 4. Bilanciare il numero di elettroni acquistati e ceduti moltiplicando entrambe le semi-reazioni per un numero intero appropriato. Quest’ultimo viene determinato facendo il minimo comune multiplo. Nel caso specifico esso è 10 e quindi la semi-reazione di riduzione va moltiplicata per 2 mentre quella di ossidazione va moltiplicata per 5.
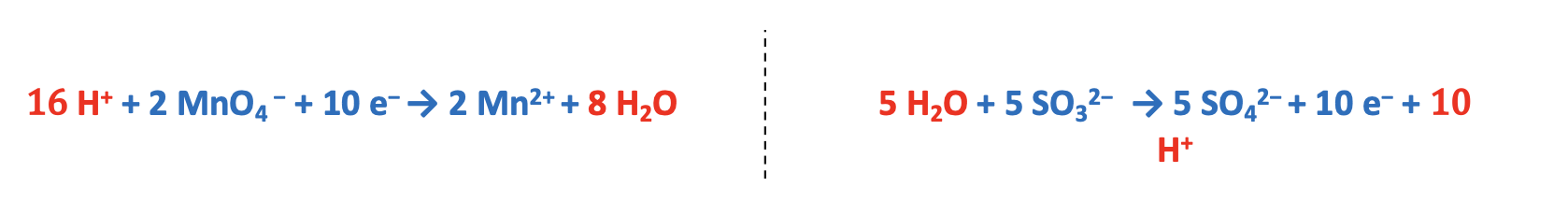
Step 5. Sommare le semi-reazioni e semplificare le specie presenti da entrambi i lati.

7. Esempio bilanciamento reazioni Red-Ox in ambiente basico /1
Metodo delle semi-reazioni forma ionica ambiente basico
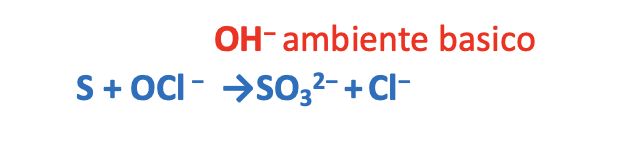
Step 1. Assegnare i numeri di ossidazione.
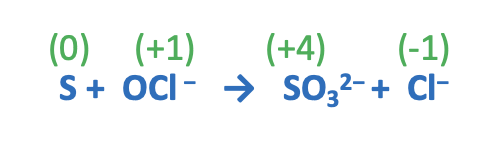
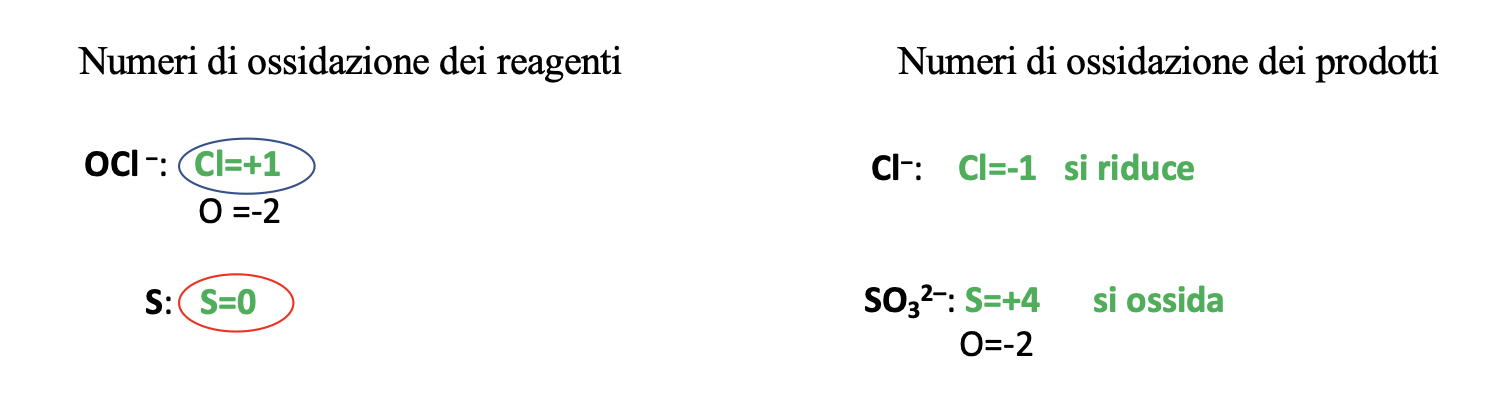
Step 2. Scrivere le semi-reazioni di ossidazione e di riduzione comprensive del numero di elettroni ceduti e acquistati.

8. Esempio bilanciamento reazioni Red-Ox in ambiente basico /2
Step 3. Bilanciare le due semi-reazioni in termini di massa e carica.
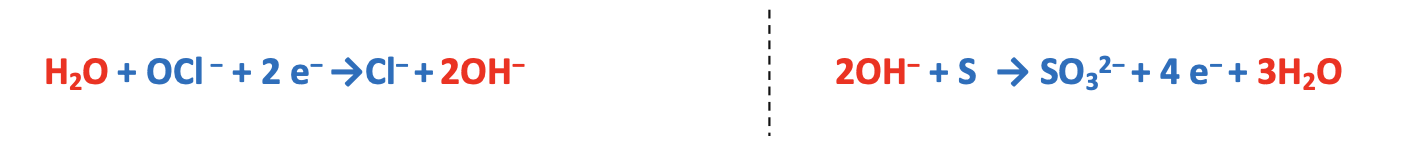
Step 4. Bilanciare il numero di elettroni acquistati e ceduti moltiplicando entrambe le semi-reazioni per un numero intero appropriato. Quest’ultimo viene determinato facendo il minimo comune multiplo. Nel caso specifico esso è 4 e quindi la semi-reazione di riduzione va moltiplicata per 2 mentre quella di ossidazione va moltiplicata per 1.

Step 5. Sommare le semi-reazioni e semplificare le specie presenti da entrambi i lati.
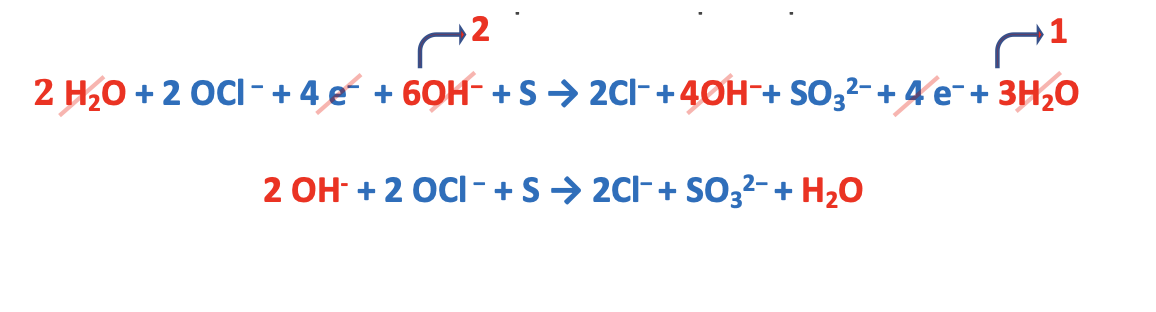
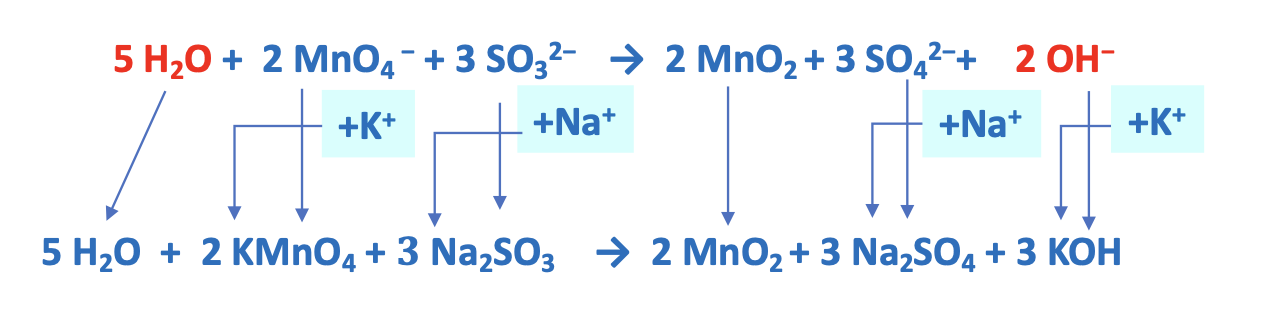
9. Esempio reazione di dismutazione
Reazioni di dismutazione o disproporzione: reazioni in cui una stessa specie chimica in parte si ossida e in parte si riduce. In ambiente basico (OH-).

Per il bilanciamento si seguono i passaggi già illustrati. Consiglio: invertire la reazione.
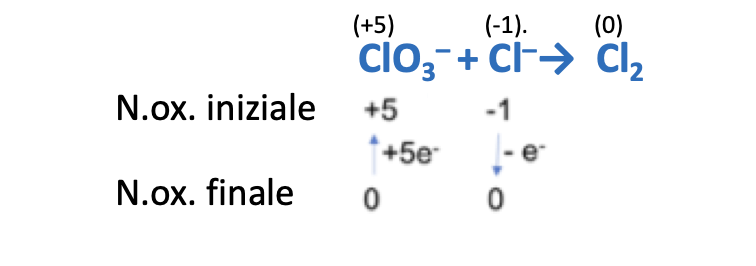

Prima di procedere al bilanciamento delle cariche elettriche, invertire nuovamente la reazione.
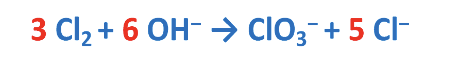
Bilanciamento di H e O con aggiunta di H2O.