Fissaidee 1
| Site: | Federica Web Learning - LMS |
| Course: | Scienze chimiche di base |
| Unit: | Fissaidee 1 |
| Printed by: | Utente ospite |
| Date: | Tuesday, 26 August 2025, 7:01 PM |
Table of contents
- 1. Le Reazioni Chimiche
- 2. Classificazione delle reazioni chimiche
- 3. Bilanciamento degli Schemi di Reazione
- 4. Definizione del concetto di mole e della costante di Avogadro
- 5. Conversione della quantità di massa in moli e numero di atomi
- 6. Relazione tra il numero di moli (quantità chimica) e massa negli schemi di reazione
- 7. Reagente limitante, reagente in eccesso e resa di una reazione
- 8. Reagente limitante, reagente in eccesso e resa di una reazione: un esempio culinario
- 9. Reagente limitante, reagente in eccesso e resa di una reazione: un esempio chimico
1. Le Reazioni Chimiche
Un pezzo di legno che marcisce, una catena di ferro che arrugginisce, un cibo sottoposto a cottura, la produzione industriale di un fertilizzante o di una plastica, il mosto d’uva che si converte in vino, la produzione di un farmaco e il suo effetto curativo su un paziente, o la replicazione di una cellula, sono tutti esempi della capacità di trasformazione della materia. Quando la materia va incontro a una trasformazione, ciò è dovuto al decorso di una o più reazioni chimiche. Il decorso di una reazione chimica è spesso accompagnato da fenomeni che possiamo percepire con i sensi. Per esempio, alcune reazioni implicano una variazione di colore del sistema, la formazione o scomparsa di un solido, lo sviluppo di gas, il rilascio/assorbimento di calore, o l’emissione di radiazione luminosa. Possiamo definire una reazione chimica come un processo in cui una o più sostanze, che chiameremo reagenti, si convertono in una o più sostanze, dette prodotti. Tale processo si può rappresentare con la seguente notazione sintetica (schema di reazione), nella quale la freccia rappresenta la trasformazione.Reagenti → Prodotti
A + B + …. → M + N

2. Classificazione delle reazioni chimiche
Le reazioni chimiche possono essere convenientemente classificate in due macro-categorie, ovvero reazioni redox (dette anche di ossidoriduzione) e reazioni non-redox.
Tra le prime troviamo le cosiddette reazioni di formazione, che implicano la conversione di uno o più elementi in un unico prodotto e le reazioni di combustione, nelle quali una sostanza reagisce con ossigeno portando alla formazione di ossidi stabili degli elementi costituenti quali CO2, H2O, SO2 e simili.
Tra i processi non redox possiamo considerare: le reazioni acido-base, che coinvolgono sostanze con comportamento acido-base e implicano consumo, formazione o scambio di ioni H+ e/o OH-; le reazioni di precipitazione, così definite perché coinvolgono la formazione di prodotti solidi a partire da specie solubili nell’ambiente di reazione (generalmente, una soluzione acquosa).
Esistono reazioni che possono essere classificate in riferimento al ruolo chimico di un particolare reagente, alle caratteristiche del prodotto ottenuto, o alle condizioni di reazione impiegate.
Nelle reazioni di decomposizione, un composto (molto spesso un solido) viene scisso in due o più sostanze a causa di temperature elevate (reazioni di decomposizione termica).
Come ultimo tipo di processo identificato sulla base delle caratteristiche (in questo caso fisiche) di uno dei prodotti, possiamo citare le reazioni che sviluppano gas.

3. Bilanciamento degli Schemi di Reazione
Nel corso di una qualunque reazione chimica, la conversione dei reagenti nei prodotti comporta la rottura di alcuni legami e la formazione di altri, ma il numero totale di atomi di ciascun elemento presente nei reagenti non può variare rispetto al numero totale di atomi di ciascun elemento presente nei prodotti, altrimenti avremmo creato o distrutto materia, violando la legge di conservazione della massa il cui enunciato è “nulla si crea, nulla si distrugge, tutto si trasforma”. Per comprendere questo concetto, pensiamo alla reazione tra ossigeno e ammoniaca e immaginiamo di avere inizialmente introdotto in un recipiente chiuso una molecola di NH3 e una di O2. Ci si può facilmente rendere conto che nelle condizioni “iniziali” il recipiente contiene 1 atomo di azoto e 3 di idrogeno (1 molecola di NH3) nonché 2 di ossigeno (1 molecola di O2). Quando la reazione avviene in linea con quanto previsto dalla seguente equazione: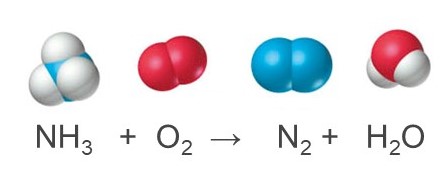
nelle condizioni “finali” il recipiente dovrebbe contenere 2 atomi di azoto (1 molecola di N2), nonché 2 di idrogeno e 1 di ossigeno (1 molecola di H2O). La natura di reagenti e prodotti è ben descritta, ma lo schema di reazione non tiene correttamente conto del rapporto di combinazione tra le molecole di reagenti, né di quello di formazione dei rispettivi prodotti, dando una reazione non bilanciata.
Bilanciare una reazione significa individuare i valori numerici dei coefficienti stechiometrici, indicati con i simboli generici a, b, … m, n, … affinché il numero di atomi di ciascun elemento rimanga invariato nella conversione dei reagenti in prodotti.
a A + b B + … → m M + n N + …
Per esempio, con riferimento alla reazione tra ammoniaca e ossigeno a dare azoto e acqua, si può facilmente verificare che l’impiego dei seguenti coefficienti stechiometrici: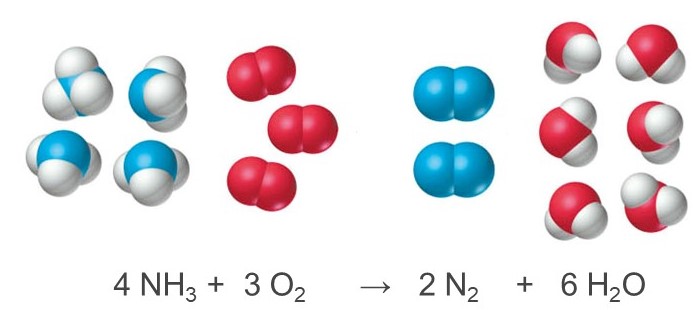
conduce a una reazione bilanciata. Queste semplici relazioni numeriche (ad esempio, NH3 e O2 reagiscono in rapporto 4:3, N2 si forma con un rapporto 2:3 rispetto a O2) non sono valide se esprimiamo le quantità di reagenti e prodotti in massa (per esempio, in grammi o in chilogrammi).
4. Definizione del concetto di mole e della costante di Avogadro
Le trasformazioni chimiche dipendono dal numero di particelle (atomi, molecole, ioni) che costituiscono le sostanze, piuttosto che dalla massa di queste ultime. Risulta quindi molto utile definire un’unità di misura della quantità di materia che non si riferisce alla massa del campione, bensì al numero di particelle in esso contenute. Tale unità è la mole (abbreviata con mol): essa è la quantità di sostanza che contiene un numero di particelle (atomi, molecole, ioni o altro) pari a 6.0221415·1023. Questo numero si chiama costante di Avogadro (o numero di Avogadro, NA). Fino a qualche anno fa, la mole era definita come la quantità di sostanza che contiene tante particelle quanti sono gli atomi presenti in 12.0000 g di carbonio-12; tale numero corrisponde alla costante di Avogadro. Questa definizione è ragionevole poiché una massa di 12 g di carbonio-12 è una quantità di sostanza che può stare nel palmo d'una mano

e quindi è vicina alla nostra percezione e in secondo luogo, notiamo che la massa di una mole di atomi di 12C è numericamente uguale alla massa atomica relativa del carbonio-12. Il valore del peso atomico (o molecolare) di qualsiasi sostanza, espresso in u, è uguale a quello della sua massa molare, espresso in g.mol–1.
5. Conversione della quantità di massa in moli e numero di atomi
Nella pratica non possiamo misurare direttamente il numero di moli contando tutti gli atomi presenti in una sostanza; ciò che facciamo abitualmente è misurare la massa attraverso una bilancia. Proprio come quando si vuole conoscere il numero di scatole contenenti una dozzina (12) di cioccolatini presenti nel grande magazzino di una industria dolciaria pesando tutte le scatole di cioccolatini assieme (un bancale) e sapendo quanto pesa una scatola di cioccolatini
così noi vogliamo conoscere il numero di moli di atomi in una data massa di atomi. Dal momento che gli atomi sono troppo piccoli per essere contati, usiamo la loro massa. È quindi molto importante capire come possiamo convertire la quantità di sostanza fra moli e grammi (o chilogrammi).
Nota la massa molare della sostanza, si può facilmente calcolare il numero di moli di un campione conoscendo la sua massa:
n [mol] = m [g] / MM [g.mol–1]
m [g] = MM [g.mol–1]·n [mol]
Una volta venuta a conoscenza del numero di moli basterà moltiplicare il numero di moli per Na per ottenere il numero di atomi presenti in maniera del tutto analoga di quando ottenuto il numero di scatole di cioccolatini basterà moltiplicare per 12 per avere il numero totale di cioccolatini a disposizione
numero di atomi = n [mol] ·Na [numero di atomi · mol–1]
6. Relazione tra il numero di moli (quantità chimica) e massa negli schemi di reazione
Una reazione chimica bilanciata esprime le quantità relative di reagenti e di prodotti che si consumano e si formano durante il processo tramite i coefficienti stechiometrici. Quando si ragiona in termini quantitativi su una reazione chimica bilanciata, è importante saper convertire “grammi in moli” o “moli in grammi”, a seconda delle informazioni necessarie. Se, per esempio, in una reazione compaiono due specie indicate genericamente con A e B, e si conosce la massa di A coinvolta nel processo (consumata o prodotta a seconda che si tratti di un reagente o un prodotto), per calcolare la massa di B che partecipa alla reazione occorre procedere come segue: si converte la massa di A in moli, utilizzando la rispettiva massa molare; poi si determinano le moli di B che sono nel giusto rapporto numerico con le moli di A in base ai coefficienti stechiometrici della reazione bilanciata; e infine si convertono le moli di B in massa, utilizzando la rispettiva massa molare.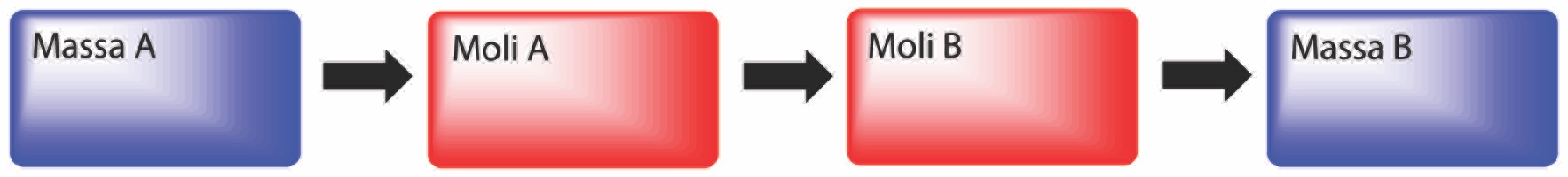
Questi calcoli sono importantissimi in chimica perché ci permettono di comprendere in maniera quantitativa le reazioni chimiche. Così come abbiamo la necessità di conoscere le relazioni quantitative tra i diversi ingredienti di una ricetta, allo stesso modo, per effettuare una reazione chimica, dobbiamo conoscere le relazioni quantitative tra reagenti e prodotti.
7. Reagente limitante, reagente in eccesso e resa di una reazione
Sebbene, in una qualunque trasformazione chimica, i reagenti si convertano nei prodotti obbedendo sempre alla legge di conservazione della massa, in taluni casi essi non sono presenti a inizio reazione nei corretti rapporti stechiometrici. Quando ciò accade, il reagente (o i reagenti) la cui quantità relativa risulta inferiore rispetto ai vincoli imposti dalla stechiometria di reazione viene detto reagente limitante (o reagente in difetto), in quanto esso condiziona (limita) la quantità massima di prodotti ottenibili. La presenza di un reagente limitante fa sì che vi sia almeno uno, fra gli altri reagenti, che non si consumerà completamente nel corso della reazione, e che per tale motivo prenderà il nome di reagente in eccesso. La resa teorica è la quantità (generalmente in grammi) di prodotto che è possibile ottenere in una reazione chimica in base alla quantità del reagente limitante. La resa effettiva in una reazione chimica è la quantità di prodotto (generalmente in grammi) effettivamente formata, mentre la resa percentuale è la resa reale divisa per la resa teorica e moltiplicata per 100.
8. Reagente limitante, reagente in eccesso e resa di una reazione: un esempio culinario
Immaginiamo che degli amici vengano a trovarci a casa per una pizzata insieme. Per preparare una singola pizza è necessario un impasto, due cucchiai di salsa di pomodoro e una mozzarella (la nostra reazione bilanciata!). Tuttavia, dopo aver controllato in frigorifero e frugato in dispensa, ci rendiamo conto di avere 3 impasti, una quantità di salsa che equivale a 10 cucchiai e 4 mozzarelle. Chiaramente, in una situazione di questo tipo, il numero di pizze che possiamo preparare (il nostro prodotto di reazione) dipenderà dal numero di impasti a disposizione, che svolgono pertanto il ruolo di reagente limitante. Si noti anche che, quando avremo preparato tutti le pizze possibili e gli impasti saranno finiti, ci rimarrà inevitabilmente una mozzarella in eccedenza e una quantità di salsa di 10 – (3*2) = 4 cucchiai.

Nell’esempio considerato, le mozzarelle e la salsa di pomodoro si comportano da reagente in eccesso: essi sono cioè inizialmente presenti in quantità superiore rispetto a quella che il reagente limitante (impasto) è in grado di consumare.
9. Reagente limitante, reagente in eccesso e resa di una reazione: un esempio chimico
In un motore termico di un’automobile avviene la reazione di combustione tra il combustibile che può essere benzina, diesel, metano o GPL (gas propano liquido) e il comburente (ossigeno) che porta alla formazione di biossido di carbonio, acqua ed energia che serve a far muovere l’automobile.
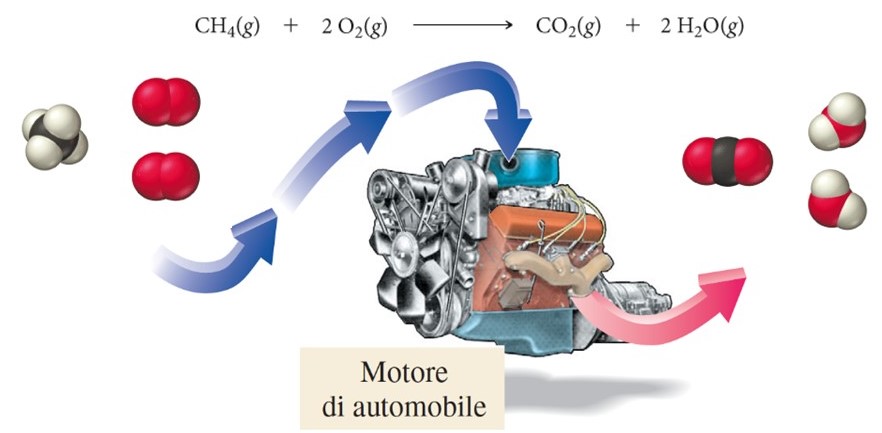
È esperienza comune che quando il livello del carburante è prossimo allo zero occorre fermarsi a fare rifornimento per evitare che il motore si spenga. Quello che succede è che durante la reazione di combustione il comburente è (spesso) in eccesso ed è il combustibile il reagente limitante. Come esempio numerico prendiamo la reazione di combustione del metano (CH4) e mettiamo a reagire 16 moli di O2 con 5 moli di CH4.
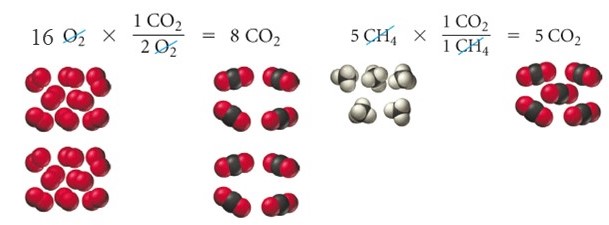
Quello che osserviamo è che possiamo ottenere ‘solo’ 5 moli di CO2 poiché il CH4 è il reagente limitante. Facendo due calcoli stechiometrici possiamo osservare che partendo da 1 kg di metano gassoso otteniamo circa 2.75 kg di biossido di carbonio percorrendo circa 20 km. Risulta evidente che la quantità di biossido di carbonio riversata nell’atmosfera è notevole.