Fissaidee 2
| Site: | Federica Web Learning - LMS |
| Course: | Scienze chimiche di base |
| Unit: | Fissaidee 2 |
| Printed by: | Utente ospite |
| Date: | Tuesday, 26 August 2025, 7:01 PM |
Table of contents
- 1. La cinetica chimica /1
- 2. La cinetica chimica /2
- 3. La velocità di reazione
- 4. La legge cinetica: effetto della concentrazione sulla velocità di reazione /1
- 5. La legge cinetica: effetto della concentrazione sulla velocità di reazione /2
- 6. Legge cinetica integrata e il tempo di dimezzamento
- 7. Effetto della temperatura sulla velocità di reazione
- 8. Catalisi
1. La cinetica chimica /1
La cinetica chimica studia la velocità con la quale decorrono le reazioni chimiche. Una reazione chimica avviene conseguentemente al fatto che alcuni legami chimici (non necessariamente tutti) presenti nei reagenti si rompono e nuovi legami chimici, che quindi sono presenti nei prodotti, si formano. Consideriamo, per esempio, la generica reazione sotto riportata. Ciò che accade è la rottura dei legami A-A e B-B con successiva formazione del legame A-B.
A2 + B2 → 2AB
Se viene preso in considerazione il fattore tempo, ne consegue che tale reazione potrà avvenire con una determinata velocità. Potrebbe essere veloce, molto veloce o addirittura istantanea o, per contro, potrebbe essere lenta, molto lenta o addirittura talmente lenta da non avvenire in tempi ragionevoli. Tale velocità può dipendere dalla natura stessa dei reagenti e dei prodotti e dovrebbe essere legata alla tempistica con cui si rompono i legami A-A e B-B e un'altrettanta tempistica con la quale si forma il legame A-B.
2. La cinetica chimica /2
In figura sono messe a confronto due reazioni di uguale stechiometria che decorrono con diversa velocità. Partendo da quantità equimolari dei reagenti (A e B oppure X ed Y) si ottengono i prodotti di reazione C e Z, rispettivamente. Le due reazioni sono monitorate nel tempo, ovvero vengono misurate le quantità di reagenti e di prodotto presenti a quattro diversi intervalli di tempo:
Quello che risulta evidente è che la reazione tra i reagenti A e B è più veloce dell’altra, in quanto è già terminata entro l’ora di reazione mentre, allo stesso tempo, nell’altro reattore è ancora presente una certa quantità dei reagenti X e Y. L’obiettivo fondamentale della cinetica chimica è la comprensione del meccanismo di reazione, ovvero la sequenza di eventi elementari che conduce dai reagenti ai prodotti, attraverso una serie di misure e una attenta e meticolosa analisi e interpretazione dei risultati sperimentali. Determinare il meccanismo di reazione ha come importante conseguenza la possibilità di intervenire sulla reazione chimica in oggetto per tentare di velocizzarla, cambiando la quantità dei reagenti, modificando la temperatura o attraverso l’utilizzo di opportuni e specifici catalizzatori.
3. La velocità di reazione
In cinematica, la velocità media viene definita come il rapporto tra la distanza percorsa e il tempo impiegato per coprire tale distanza. Durante il procedere lungo tale distanza tuttavia la velocità istantanea avrà subito variazioni continue ed è quella indicata, in un certo istante, ad esempio sul tachimetro di un’automobile. La velocità istantanea corrisponde alla derivata dello spazio fatta rispetto al tempo. In cinetica chimica la velocità viene definita in modo del tutto analogo, anche per una reazione chimica si può parlare quindi di velocità media e di velocità istantanea. La grandezza che varia nel tempo è la concentrazione molare di reagenti e prodotti. Prendiamo nuovamente in considerazione la reazione:
A2 + B2 → 2AB
La velocità istantanea (d’ora in avanti v per semplicità) della reazione è esprimibile come segue:
v = - d[A2]/dt = - d[B2]/dt = +1/2 d[AB]/dt
Poiché la concentrazione dei reagenti nel tempo diminuisce, i differenziali d[A2] e d[B2] sono negativi, mentre il differenziale del prodotto è positivo. Infine, affinché la velocità risulti indipendente dalla specie considerata e per rispettare il principio di conservazione della massa, la derivata per quanto concerne il prodotto AB viene moltiplicata per il reciproco del suo coefficiente stechiometrico.
4. La legge cinetica: effetto della concentrazione sulla velocità di reazione /1
Uno degli obiettivi di uno studio cinetico di una reazione chimica consiste nel ricavare delle equazioni che consentano di prevedere in che modo la velocità di reazione dipenda dalle concentrazioni dei reagenti o dal tempo. Per determinare la velocità di una reazione occorre misurare le variazioni di concentrazione (dei reagenti e/o dei prodotti) nel tempo attraverso diversi metodi analitici e spettroscopici

Nell'immagine: la reazione di H2 e I2 a formare HI può essere seguita spettroscopicamente poiché I2 è viola e H2 e Hl sono incolori. Al reagire di I2 con H2 per formare Hl, il colore violetto della miscela di reazione diventa via via più tenue. L'attenuazione del colore (correlata alle concentrazioni dei reagenti e prodotti) può essere monitorata con uno spettrometro.
La velocità di una reazione spesso dipende dalla concentrazione di uno o più reagenti. Per semplicità se consideriamo una reazione in cui un reagente, A, si decompone:
A → 2B
Se la reazione va a completamento (o fino a quando la velocità della reazione inversa è trascurabile) è possibile ricavare sperimentalmente una relazione, detta legge cinetica (o legge della velocità o equazione della velocità), tra la velocità di reazione e la concentrazione del reagente, nel modo seguente:
v=k[A]n
in cui k è una costante di proporzionalità detta costante di velocità e il suo valore dipende dal tipo di reazione, dal meccanismo di reazione, dalla presenza di (eventuali) catalizzatori e dalla temperatura e n è l'ordine di reazione.
5. La legge cinetica: effetto della concentrazione sulla velocità di reazione /2
Il valore di n (di solito un numero intero) determina il modo in cui la velocità dipende dalla concentrazione del reagente nella equazione cinetica v=k[A]n per la reazione A che da 2B
Se n=0, la reazione è di ordine zero e la velocità è indipendente dalla concentrazione di A (la concentrazione del reagente diminuisce linearmente nel tempo).
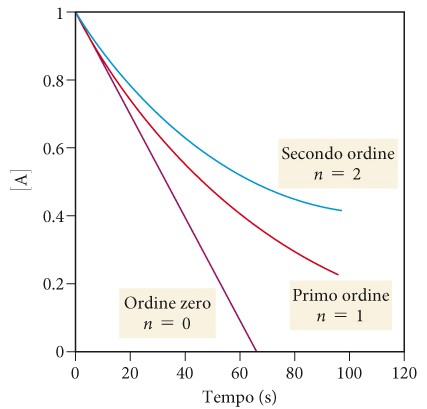
Appartengono a questa categoria molte reazioni catalizzate da enzimi
Se n=1, la reazione è del primo ordine e la velocità è direttamente proporzionale alla concentrazione di A e diminuisce al procedere della reazione perché la concentrazione del reagente diminuisce. Una importante reazione del primo ordine è la scissione del saccarosio (comune zucchero da cucina) in glucosio e fruttosio.
Se n=2, la reazione è del secondo ordine e la velocità è proporzionale al quadrato della concentrazione di A di conseguenza, la velocità è ancora più sensibile alla concentrazione del reagente rispetto a una del primo ordine.
Se consideriamo questa generica reazione: aA + bB → cC + dD
Fino a quando la reazione inversa è trascurabile, la legge cinetica è proporzionale al prodotto della concentrazione di A, elevata a m, per la concentrazione di B, elevata a n: in cui m è l'ordine della reazione rispetto ad A e n è l'ordine di reazione rispetto a B. L'ordine totale è la somma degli esponenti (m + n).
6. Legge cinetica integrata e il tempo di dimezzamento
Se si vuole sapere come la concentrazione del reagente A nella reazione A che da 2B varierà nel tempo un’altra equazione utile è la legge cinetica integrata che esprime la concentrazione dei reagenti in funzione del tempo. Applicando, ad esempio, il calcolo integrale alla legge cinetica del primo ordine si ottiene
[A]t =-kt + [A]0
Un altro modo per valutare il decorso di una reazione è quello di considerare il tempo di dimezzamento (o la semivita) di una reazione che è il tempo richiesto per dimezzare la concentrazione di un reagente rispetto al suo valore iniziale. Per una reazione del primo ordine in A:
t=t1/2; [A]t=[A]0/2
Nella tabella sono riassunte le principali formule e grafici per i tre ordini di reazione (0, 1 e 2) per una generica reazione di A che va a prodotti.

7. Effetto della temperatura sulla velocità di reazione
L’esperienza pratica suggerisce che le reazioni siano più veloci con l’aumento della temperatura infatti partendo dalla temperatura ambiente, un aumento della temperatura di 100° C può far aumentare la velocità di una reazione di uno o due ordini di grandezza.
La dipendenza dalla temperatura della velocità della reazione è contenuta nella costante di velocità, k (che è realmente una costante solo quando la temperatura rimane costante). Un aumento della temperatura generalmente porta ad un aumento della k, e di conseguenza ad una velocità maggiore.
Il chimico svedese Svante Arrhenius nel 1889 scrisse un’equazione che porta il suo nome in cui viene mostrata la relazione tra la costante di velocità (k) e la temperatura in kelvin (T):
k = A e-Ea/RT
In questa equazione, R è la costante dei gas (8.314 j K/mol), A è una costante detta fattore di frequenza (o fattore pre-esponenziale), e Ea è l'energia di attivazione (o barriera di attivazione).
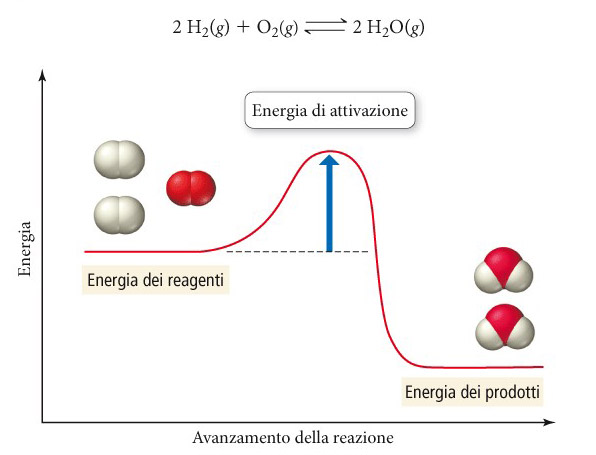
L'equazione ottenuta empiricamente è in accordo con la teoria delle collisioni che enfatizza l'importanza della frequenza delle collisioni molecolari e della necessità di una favorevole orientazione delle molecole nelle collisioni (fattore A) nonché della frazione delle collisioni dotata di sufficiente energia per produrre una reazione (fattore esponenziale).
8. Catalisi
La catalisi è un settore della cinetica chimica che si interessa di sintesi, sviluppo e applicazione dei catalizzatori alle reazioni chimiche. Un catalizzatore è una sostanza che introdotta nell’ambiente di reazione è in grado di velocizzare la reazione senza essere consumato dalla reazione stessa. Il catalizzatore deve essere utilizzato in rapporto molare inferiore (anche di molto) rispetto al valore stechiometrico e dovrebbe essere recuperato integralmente a fine reazione (questo nella realtà non accade in quanto qualsiasi catalizzatore ha un suo tempo di vita). Una reazione catalizzata avviene con un meccanismo diverso da quella non catalizzata.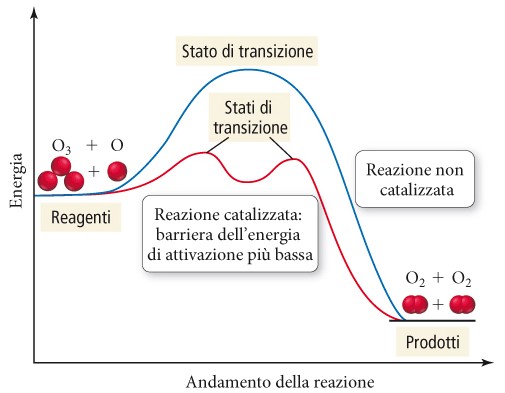
Nel nuovo meccanismo avremo in generale una minore energia di attivazione e un aumento del fattore presponenziale. Il catalizzatore funziona ciclicamente (si utilizza infatti il termine ciclo catalitico) ed è questo il motivo per cui ne serve una quantità molare inferiore rispetto ai reagenti. Più cicli catalitici è in grado di fare il catalizzatore, prima di degradarsi e smettere di funzionare, e maggiore è la sua attività catalitica. Convenientemente la catalisi viene suddivisa in tre grossi settori:
- catalisi omogenea;
- catalisi eterogenea;
- catalisi enzimatica.