Fissaidee 3
| Site: | Federica Web Learning - LMS |
| Course: | Scienze chimiche di base |
| Unit: | Fissaidee 3 |
| Printed by: | Utente ospite |
| Date: | Tuesday, 26 August 2025, 7:01 PM |
1. Equilibrio chimico dinamico. Introduzione
Prendiamo in considerazione la solita reazione
A2 + B2 → 2AB
A2 e B2 possono collidere e reagire per formare 2 molecole di AB, ma anche 2 molecole AB possono urtarsi e reagire per riformare A2 e B2. Una reazione che può procedere in direzione sia diretta (da sinistra verso destra) sia inversa (da destra verso sinistra) è una reazione reversibile. Se inizialmente abbiamo solamente A2 e B2, queste iniziano a reagire per formare AB, tuttavia, mentre A2 e B2 reagiscono, la loro concentrazione diminuisce e quindi anche la velocità della reazione diretta diminuisce (a).
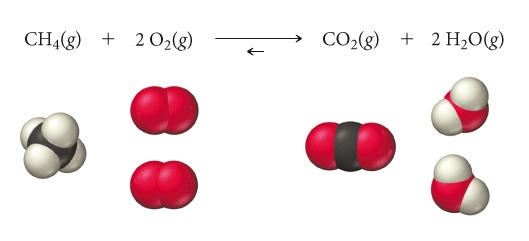
Contemporaneamente, AB comincia a formarsi e, con l’aumento della concentrazione di AB, la reazione inversa comincia a svolgersi con una velocità in rapido aumento, poiché le collisioni tra molecole AB possono essere sempre più numerose (b). Alla fine, la velocità della reazione inversa (che è in fase di crescita) eguaglia quella della reazione diretta (che sta diminuendo). A quel punto è stata raggiunta la condizione di equilibrio dinamico (c e d). Nella chimica e nella fisica si ha una situazione di equilibrio se le varie parti che compongono il sistema interagiscono tra di loro in maniera che le proprietà chimiche o fisiche non cambino durante il tempo di osservazione, tuttavia non si tratta di una condizione statica, bensì dinamica, poiché le reazioni diretta e inversa stanno ancora procedendo, ma alla stessa velocità. Quando si è raggiunto l’equilibrio dinamico, le concentrazioni di A2, B2 e AB non cambiano più, rimangono costanti poiché reagenti e prodotti si consumano alla stessa velocità con cui si formano. Per evidenziare questo nella equazione chimica che rappresenta la reazione la singola freccia viene sostituita con le doppie frecce:
A2 + B2 ⇄ 2AB
2. Costante di equilibrio
Considerando la generica reazione all’equilibrio:
aA + bB ⇄ cC + dD
dove A e B sono i reagenti, C e D sono i prodotti, e a, b, c e d sono i rispettivi coefficienti stechiometrici nell’equazione chimica, possiamo definire la costante di equilibrio (Keq) che rappresenta il mezzo per quantificare le concentrazioni relative di reagenti e prodotti all’equilibrio. La costante di equilibrio (Keq) della reazione è definita come il rapporto – all’equilibrio – tra il prodotto delle concentrazioni dei prodotti elevate ai loro coefficienti stechiometrici e il prodotto delle concentrazioni dei reagenti elevate ai loro coefficienti stechiometrici:
Keq=[C]c [D]d /[A]a [B]b
Occorre ricordare che nell’esprimere una costante di equilibrio oltre a considerare una reazione bilanciata bisogna anche verificare lo stato fisico in cui sono presenti i reagenti e prodotti. Se consideriamo la seguente reazione:
2 CO (g) ⇄ CO2 (g)+ C (s)
poiché il carbonio è un solido (indicato con s) mentre CO e CO2 sono gas (indicato con g), la sua concentrazione rimane costante, quindi aggiungere quantità variabili di carbonio alla miscela di reazione non cambia la sua concentrazione. La concentrazione di un solido non varia perché dipende solo dalla sua densità, la quale (con l’eccezione di piccole variazioni dovute alla temperatura) è costante finché una certa quantità di solido è presente. Di conseguenza, i solidi puri non vengono inclusi nell’espressione della costante di equilibrio. L’espressione della costante di equilibrio corretta è:
Keq =[CO2]/ [CO]2
Allo stesso modo, la concentrazione di un liquido puro non cambia. Di conseguenza, i liquidi puri – reagenti o prodotti indicati con (l) nell’equazione chimica – non vengono inclusi nell’espressione della costante di equilibrio. L’esempio più importante sono gli equilibri acido-base in soluzione acquosa.
3. Reazione quantitative vs reazioni all’equilibrio
La costante di equilibrio è una misura delle concentrazioni relative di reagenti e prodotti all’equilibrio e quindi del grado di avanzamento di una reazione; più elevata è la costante di equilibrio, maggiore è la concentrazione dei prodotti rispetto a quella dei reagenti all’equilibrio. Generalmente, un valore elevato della costante di equilibrio (Keq>>1) indica che la reazione diretta è ampiamente favorita e che, all’equilibrio, la quantità di prodotto sarà maggiore di quella di reagente. Al contrario, un valore piccolo della costante di equilibrio (Keq<<1) indica che la reazione inversa è favorita e che, all’equilibrio, la concentrazione di reagenti sarà più alta di quella dei prodotti. Portando agli estremi le precedenti affermazioni potremmo considerare le reazioni quantitative come quelle in cui le concentrazioni dei reagenti (o almeno uno, il reagente limitante) sono nulle e si ha la massima conversione dei reagenti della reazione in prodotti, come ad esempio nella reazione di combustione del metano in seguito ad un innesco iniziale. Viceversa se la concentrazione dei prodotti è pari a zero significa che la reazione diretta non avviene nelle condizioni esplicitate. Ad esempio la conversione di anidride carbonica e acqua in metano non avviene spontaneamente anche in presenza di un innesco.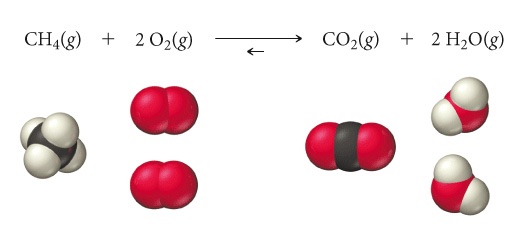
4. Reazioni esotermiche ed endotermiche
Le trasformazioni fisiche e le reazioni chimiche sono generalmente accompagnate da variazioni di energia. Il rilascio di energia durante una reazione chimica è analogo al rilascio di energia che avviene quando lasciamo cadere un peso. Quando solleviamo un peso, aumentiamo la sua energia potenziale; quando lo lasciamo cadere, la sua energia potenziale viene rilasciata sotto forma di energia cinetica. L’energia contenuta nei legami del metano viene rilasciata quando brucia formando acqua e anidride carbonica e viene impiegata per riscaldare il cibo che stiamo cucinando. Questo tipo di reazioni chimiche che rilasciano energia si definiscono esotermiche. Alcune reazioni chimiche invece assorbono energia dall’ambiente circostante. Queste reazioni vengono definite endotermiche. L’utilizzo del ghiaccio istantaneo è un buon esempio di trasformazione fisica endotermica. Quando la barriera che tiene separati i componenti chimici viene lacerata, le sostanze si mescolano, reagiscono e assorbono calore dall’ambiente (il nostro polso dolorante) che le circonda. Infine, se una data reazione o un dato processo sono esotermici, il processo inverso deve essere endotermico.
5. Principio di Le Châtelier /1
Il principio di Le Châtelier (o equilibrio mobile) afferma che, quando un sistema chimico all’equilibrio viene perturbato, il sistema si sposta nella direzione che rende minima la perturbazione. In altre parole, un sistema all’equilibrio cerca di mantenere il proprio stato, e si oppone alla perturbazione. Il principio di Le Châtelier consente di prevedere che cosa accade a un sistema chimico all’equilibrio quando le condizioni vengono mutate. Ciò ci permette di modificare le condizioni di una reazione chimica per ottenere un dato risultato. Esistono diversi modi per perturbare un sistema chimico all’equilibrio, il primo che viene in mente è quello di considerare aggiunta/sottrazione di reagenti /prodotti all’/dall’ ambiente di reazione. Consideriamo la seguente reazione in equilibrio chimico:
N2O4 (g) ⇄ 2 NO2 (g)
Supponiamo di perturbare l’equilibrio aggiungendo NO2 alla miscela all’equilibrio. In base al principio di Le Châtelier, il sistema si sposta in direzione tale da rendere minima la perturbazione. Lo spostamento è dovuto all’aumento di concentrazione di NO2, che a sua volta determina un aumento della velocità della reazione inversa, dal momento che le velocità di reazione generalmente aumentano con la concentrazione. Per riassumere, se un sistema chimico è all’equilibrio: un aumento della concentrazione di uno o più reagenti provoca lo spostamento della reazione verso destra (in direzione dei prodotti) viceversa un aumento della concentrazione di uno o più prodotti provoca lo spostamento della reazione verso sinistra (in direzione dei reagenti). Analogamente se un sistema chimico è all’equilibrio: una diminuzione della concentrazione di uno o più reagenti provoca lo spostamento della reazione verso sinistra (in direzione dei reagenti) viceversa una diminuzione della concentrazione di uno o più prodotti provoca lo spostamento della reazione verso destra (in direzione dei prodotti).
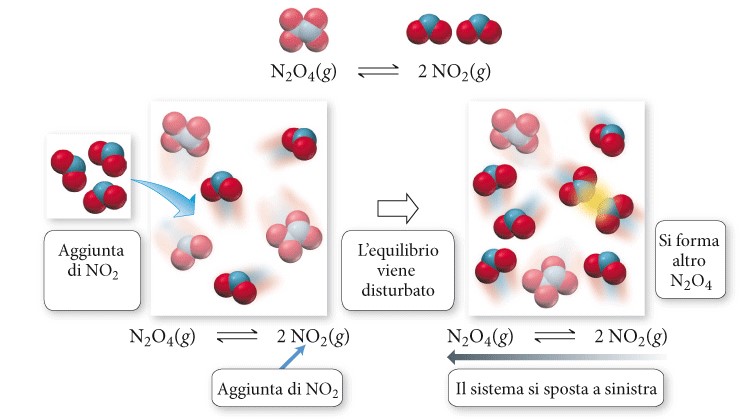
6. Principio di Le Châtelier /2
L’effetto della temperatura su una reazione ci consente di scegliere le condizioni che favoriranno una data reazione. Una variazione di temperatura provoca una variazione della costante di equilibrio. Temperature elevate favoriscono le reazioni endotermiche, mentre temperature basse favoriscono le reazioni esotermiche. La maggior parte delle reazioni procede più rapidamente a temperature elevate, per cui occorre considerare l’effetto della temperatura non solo sull’equilibrio ma anche sulla velocità. Nel dettaglio:
Per le reazioni chimiche esotermiche (il calore è un prodotto) l’aumento della temperatura provoca uno spostamento della reazione verso sinistra mentre la diminuzione della temperatura provoca uno spostamento della reazione verso destra.
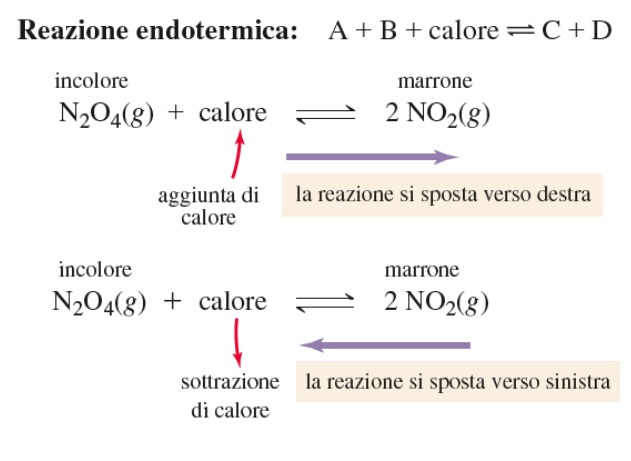

7. Principio di Le Châtelier /3
Nel caso di reazioni in fase gassosa, occorre ricordare che una variazione del volume di un gas (o di una miscela di gas) dà origine a una variazione della sua pressione (legge dei gas ideali, proporzionalità inversa). Se il volume di una miscela di reazione allo stato aeriforme all’equilibrio chimico cambia, la pressione varia e il sistema si sposterà in direzione tale da rendere minimo il cambiamento. Consideriamo, per esempio, la seguente reazione all’equilibrio, che si svolge all’interno di un cilindro dotato di un pistone mobile: N2(g) + 3 H2(g) ⇄ 2 NH3(g).
Immaginiamo di spingere il pistone verso il basso,
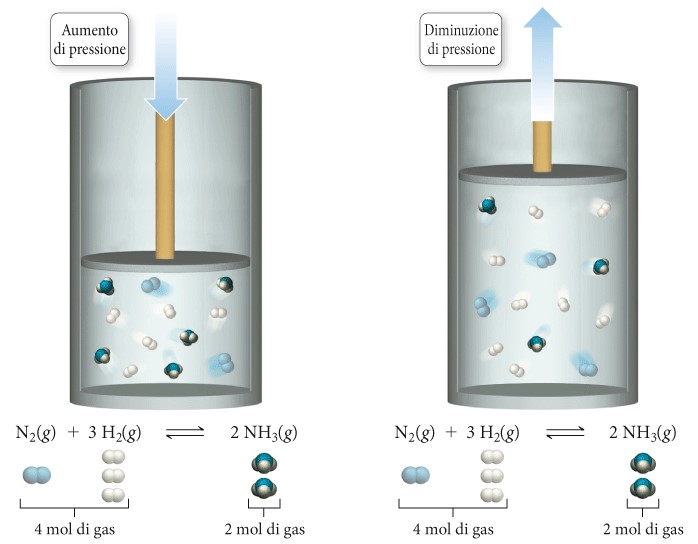
diminuendo così il volume e aumentando la pressione. Se la reazione si sposta verso destra, 4 moli di particelle allo stato aeriforme (1 mole di N2 e 3 moli di H2) si convertono in 2 moli di particelle nello stesso stato (2 moli di NH3). Perciò, con lo spostamento della reazione verso i prodotti, la pressione si abbassa (poiché la miscela contiene un numero inferiore di particelle allo stato aeriforme). Il sistema, quindi, si sposta verso destra, riabbassando la pressione e rendendo minima la perturbazione.