Fissaidee 1
| Site: | Federica Web Learning - LMS |
| Course: | Biologia di base |
| Unit: | Fissaidee 1 |
| Printed by: | Utente ospite |
| Date: | Tuesday, 26 August 2025, 9:48 PM |
1. Composizione chimica delle proteine
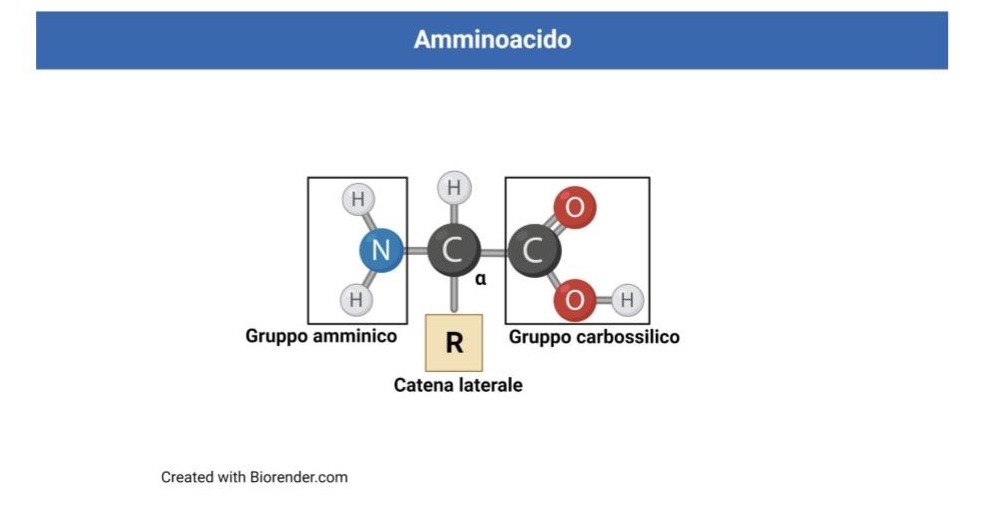
Le proteine sono macromolecole polimeriche formate dalla successione lineare di unità elementari, gli amminoacidi. Gli amminoacidi sono composti del carbonio caratterizzati da un gruppo carbossilico, -COOH, e un gruppo amminico, -NH2, legati ad un atomo di carbonio centrale detto carbonio alfa (a). In tutti gli amminoacidi, al carbonio alfa sono inoltre legati un atomo di idrogeno e una catena laterale, detta gruppo R.
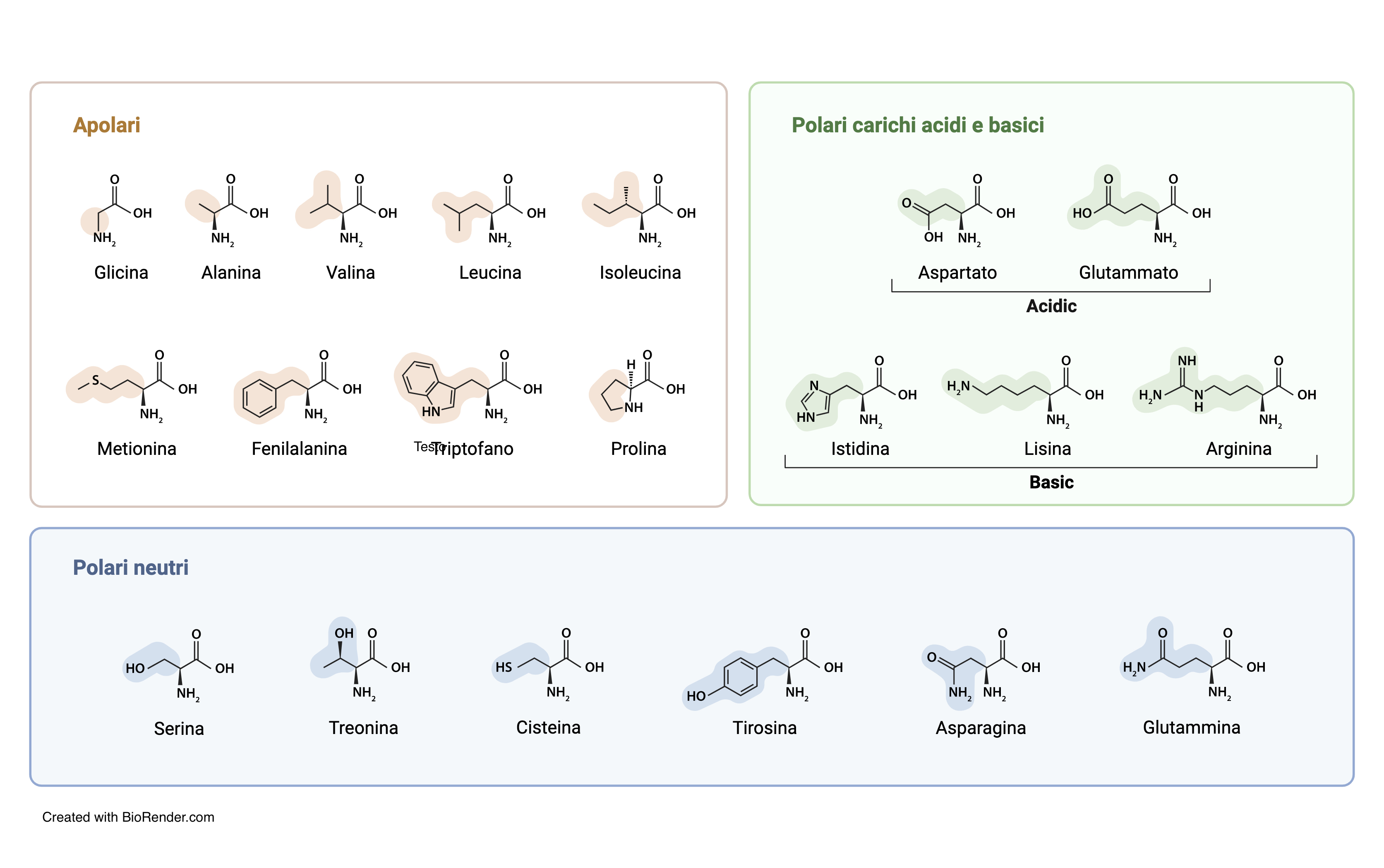
Per la presenza di un gruppo amminico e di un gruppo carbossilico, gli amminoacidi possono comportarsi sia da acidi, sia da basi. Nelle proteine sono presenti 20 tipi di amminoacidi che differiscono per la natura chimica del gruppo R. Nove di questi presentano gruppi R apolari e sono pertanto idrofobici, cioè non formano legami a idrogeno con le molecole di acqua. I restanti 11 amminoacidi presentano gruppi R polari e sono pertanto idrofilici (possono formare legami idrogeno con le molecole dell’acqua).
In alcune proteine sono inoltre presenti amminoacidi modificati chimicamente dopo la sintesi della proteina. Nelle proteine, gli amminoacidi sono uniti tra loro da un legame covalente, il legame peptidico, che si forma tra l’atomo di carbonio C del gruppo carbossilico di un amminoacido e l’atomo di azoto N del gruppo amminico dell’amminoacido successivo.
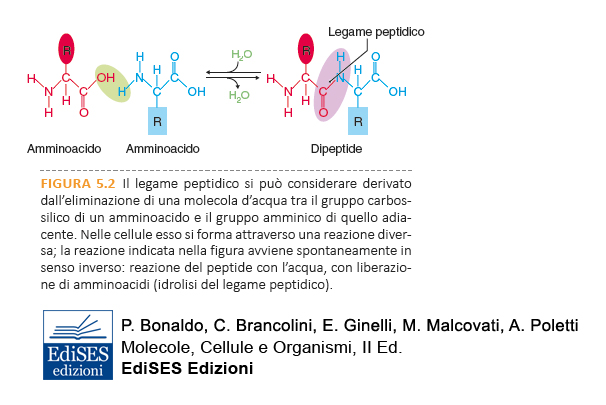
La reazione che porta alla formazione del legame peptidico è una reazione di condensazione, che comporta l’eliminazione di una molecola di acqua. La reazione inversa, di scissione del polimero nelle sue unità elementari, è la reazione di idrolisi che consiste nella rottura del legame covalente tra gli amminoacidi con l’introduzione di una molecola di acqua.
2. Struttura primaria e secondaria
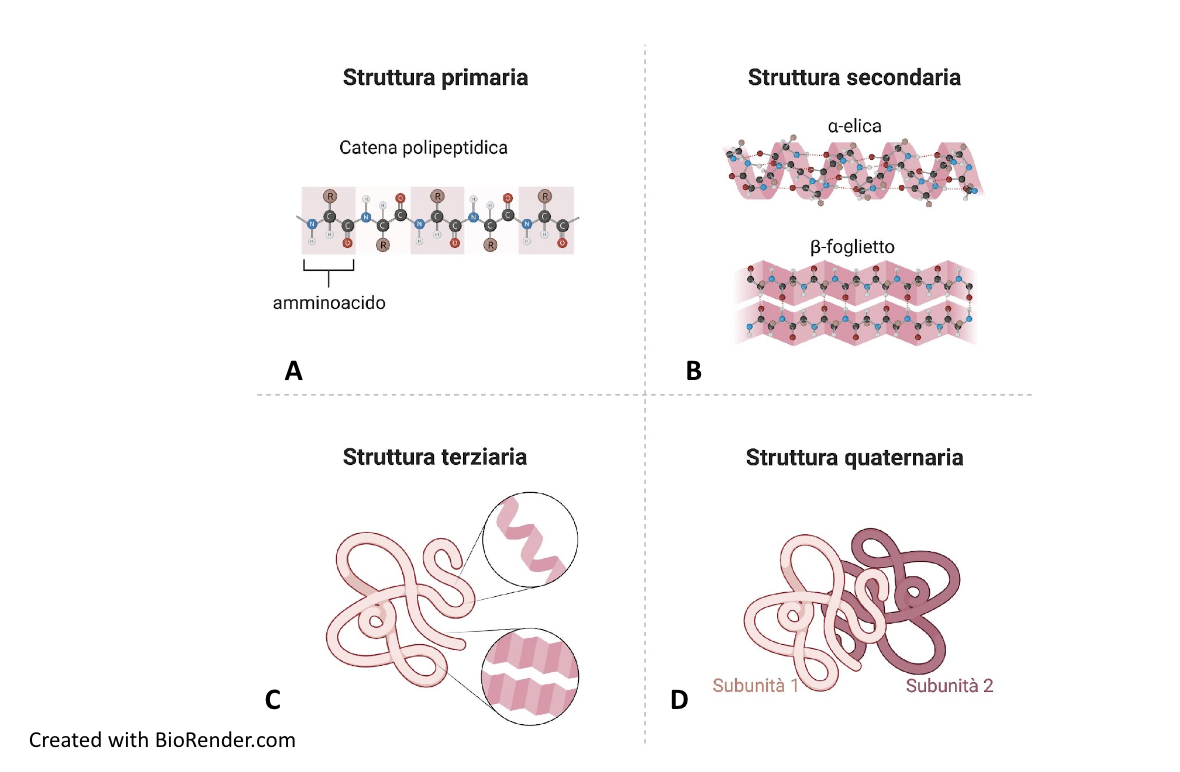
Il prodotto della polimerizzazione degli amminoacidi è un polipeptide, una catena polipeptidica che non ha ancora acquisito l’organizzazione tridimensionale tipica della proteina biologicamente attiva. Le proteine presentano diversi livelli di organizzazione strutturale: struttura primaria, secondaria, terziaria e quaternaria. La struttura primaria è la sequenza lineare degli amminoacidi che compongono la catena polipeptidica, specifica per ogni proteina (Figura A). L’informazione per la disposizione degli amminoacidi nella struttura primaria è contenuta nel genoma, codificata nella sequenza lineare dei nucleotidi del DNA. La struttura secondaria è una conformazione che riguarda segmenti della catena polipeptidica. Esistono due tipi di struttura secondaria: alfa-elica e piano o foglietto beta (Figura B).
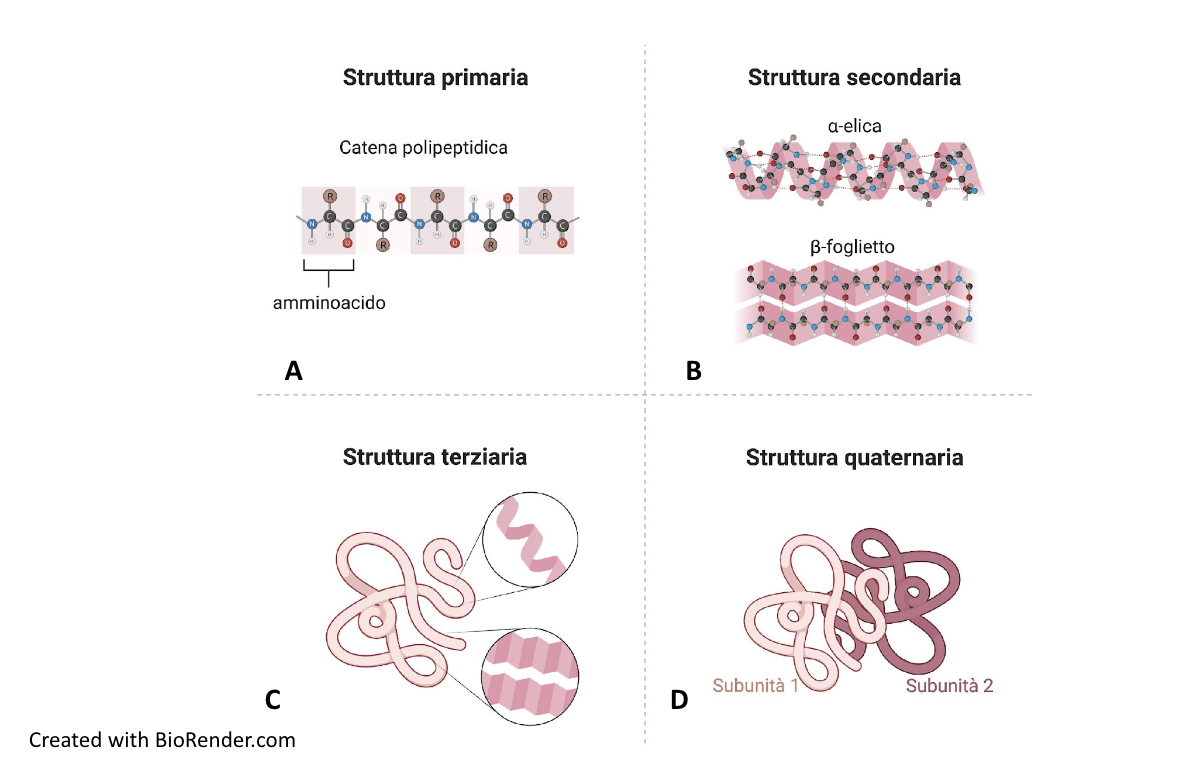
L’alfa-elica consiste in un ripiegamento elicoidale della catena, mentre il foglietto beta si realizza quando parti della catena si allineano a formare un piano pieghettato. Le due conformazioni sono stabilizzate da legami a idrogeno che si formano tra i legami peptidici di amminoacidi situati a diversa distanza lungo la catena. Nell’alfa-elica i gruppi R degli amminoacidi sporgono verso l’esterno dall’asse longitudinale dell’elica, mentre nel piano-beta i gruppi R sporgono alternativamente al di sopra o al di sotto del piano. L’alfa-elica e il piano beta sono conformazioni rigide per l’elevato numero di legami a idrogeno che si formano tra i gruppi peptidici. In molte proteine, le due conformazioni sono entrambi presenti, separate da anse o giri che conferiscono flessibilità alla catena stessa.
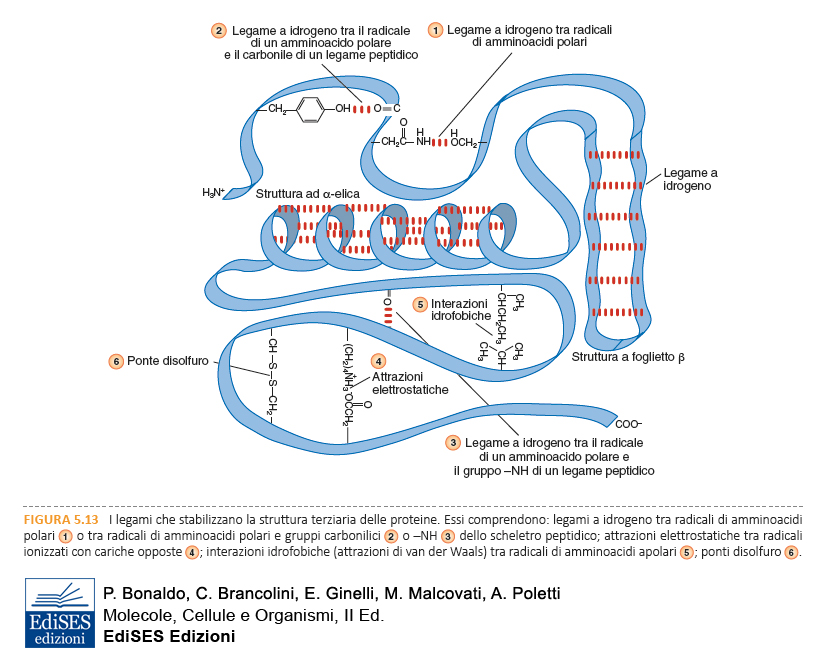
3. Struttura terziaria e quaternaria
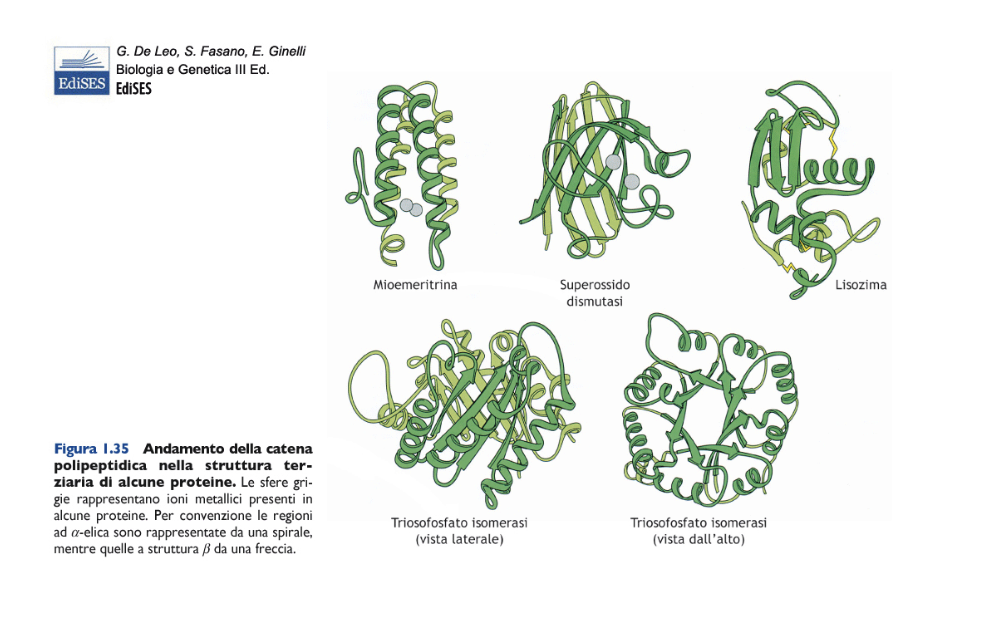
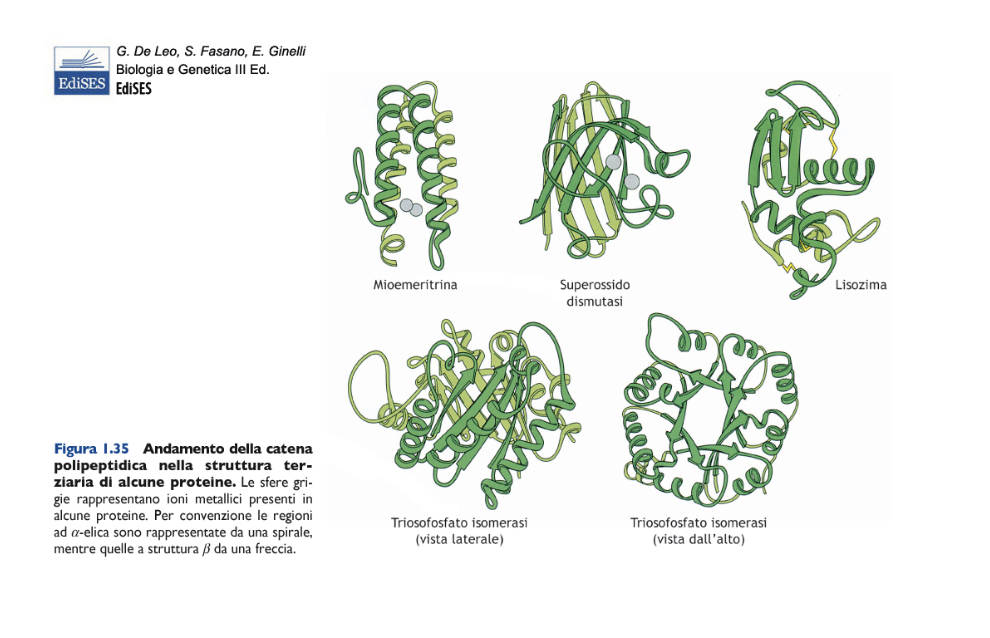
La struttura terziaria consiste nel ripiegamento tridimensionale dell’intera catena polipeptidica (Figure C e 1.35) e corrisponde allo stato nativo della proteina, ossia alla sua conformazione funzionale.
 |
 |
|---|
Molte proteine assumono una forma compatta e si definiscono proteine globulari, altre presentano una forma distesa e si chiamano proteine fibrose. Esiste però un’enorme varietà di strutture terziarie, solo in parte ricostruite tramite le tecniche di cristallografia a raggi X o di risonanza magnetica nucleare, da cui è possibile ricavare la posizione di tutti gli atomi nella molecola proteica. La struttura terziaria è stabile ma dinamica, cioè può subire cambiamenti interni, detti modificazioni conformazionali, da cui dipende la funzione della proteina.
Molte proteine sono costituite da più catene polipeptidiche, uguali o diverse tra loro, che definiscono la struttura quaternaria della proteina (Figura D). I polipeptidi sono subunità della singola molecola proteica che solo unitariamente svolge la sua specifica funzione.
Struttura terziaria e struttura quaternaria sono stabilizzate da un gran numero di legami deboli e interazioni che si stabiliscono tra le catene laterali degli amminoacidi e tra questi e le molecole di acqua.
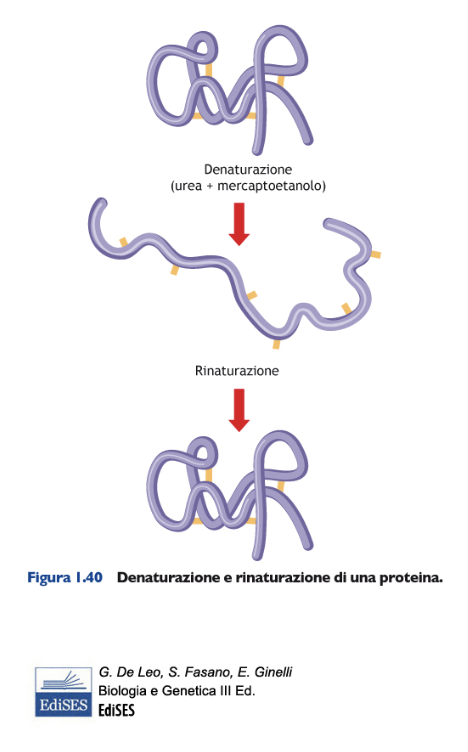
La rottura di tutti i legami deboli e dei ponti disolfuro con agenti denaturanti, come urea e mercaptoetanolo, provoca la perdita della conformazione nativa e della funzione della proteina, ossia la denaturazione della proteina stessa, che assume un’organizzazione spaziale distesa. Dopo la rimozione degli agenti denaturanti, la proteina può riavvolgersi spontaneamente (rinaturazione) riacquistando la propria attività funzionale.