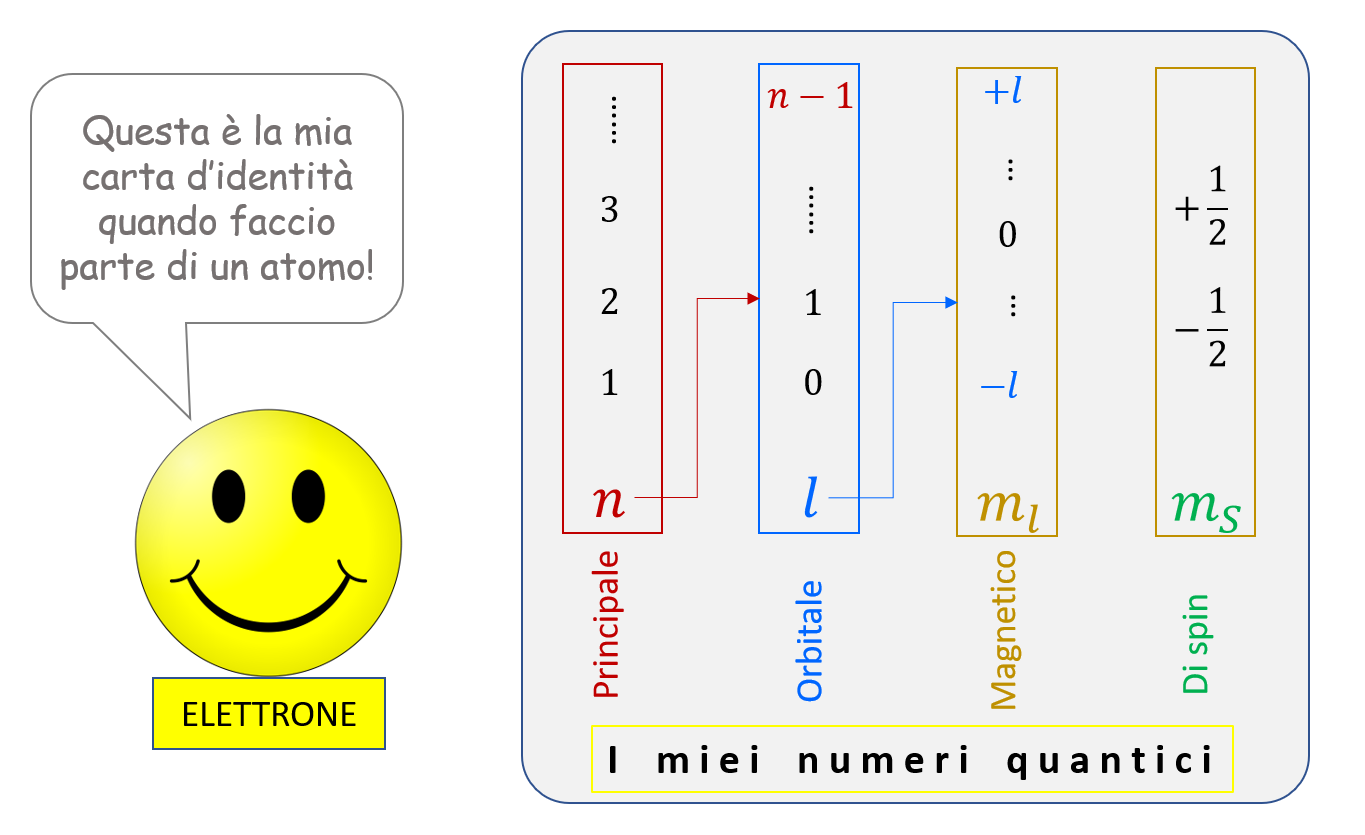
9. Lo spin e la carta d’identità completa dell’atomo /1
Con la scoperta dell’effetto Zeeman e la conseguente introduzione del numero quantico magnetico, la storia non era ancora finita! Infatti, esperimenti di spettroscopia molto accurati e in grado di distinguere righe spettrali anche molto vicine tra loro (i fisici si riferiscono a questa caratteristica parlando di “alta risoluzione in lunghezza d’onda”) misero in evidenza che molte delle righe spettrali erano in realtà costituite da due righe vicinissime tra loro, anche in assenza di campo magnetico (questa caratteristica degli spettri atomici viene denominata struttura fine). Questa ulteriore evidenza sperimentale trovò adeguata interpretazione dopo che, nel 1925, i fisici Uhlenbeck e Goudsmit introdussero un ulteriore numero quantico detto di spin. Secondo tale ipotesi, lo stato di un dato elettrone di un atomo, caratterizzato dai tre valori dei numeri quantici \( n \), \( l \) e \( m_l \), era ulteriormente specificato da questo nuovo numero quantico \( m_S \) che può assumere uno dei due valori \( -1/2 \) oppure \( +1/2 \).
La moderna visione dell’atomo è dunque basata sull’idea (ampiamente confermata dagli esperimenti) che lo “stato” di un elettrone quando fa parte di un atomo è descritto dai numeri quantici che abbiamo ricordato. Quindi lo stato di un atomo nel suo complesso è definito dall’insieme dei valori dei numeri quantici dei suoi elettroni. È un po’ come se i numeri quantici fossero le “voci” presenti sulla “carta d’identità” di un elettrone!