5. Dal calorico al calore come energia trasportata microscopicamente
Che cos’è davvero questo calore? Potrebbe essere una specie di “fluido”, una sostanza invisibile che passa da un corpo all’altro, quando vengano messi a contatto, fino a bilanciarne le temperature. Questo è di fatto ciò che pensavano i pionieri della termodinamica fino alla metà del XIX secolo, che chiamavano questo misterioso fluido “calorico”.
Ma c’è un grosso problema: la quantità di un fluido “materiale” non cambia (perché in fisica la massa si conserva), mentre è possibile far comparire del “calorico” letteralmente dal nulla. Provate infatti a sfregare vigorosamente la mano su una superficie, magari un po’ rugosa: vedrete che sia la mano che la superficie si scaldano. Perché? In realtà, per effetto dell’attrito tra la vostra mano e la superficie, avete “dissipato” il lavoro fatto per muovere la mano stessa. Quindi avete perso dell’energia meccanica, “creando” però del calore.
Che allora il calore non si altro che una forma di energia che, a differenza del lavoro meccanico, si trasporta “invisibilmente”, per via microscopica? Questa è la prima idea chiave che ha aperto le porte agli sviluppi della termodinamica. Come avete visto, James Prescott Joule riuscì proprio a stabilire un equivalente meccanico del calore, mostrando che:
\( 1 \textbf{cal} =4{,}186\, \textbf{J} \)
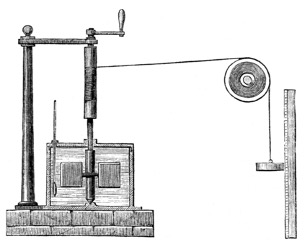
Il mulinello di Joule
