7. Dagli scaldamuscoli ai motori: il Secondo Principio
Il Secondo Principio della termodinamica esprime un concetto molto semplice e che è sicuramente in accordo con la nostra esperienza quotidiana: si può scaldare un corpo mettendolo a contatto con un corpo più caldo, ma non viceversa! Per essere più precisi, dovremmo dire, come disse Rudolf Clausius attorno a metà dell’800, che
“È impossibile realizzare una trasformazione termodinamica il cui unico risultato sia quello di far passare del calore da una sorgente a temperatura inferiore a una a temperatura superiore”
dove la specificazione “unico” è essenziale, altrimenti il Secondo Principio sarebbe banalmente violato da un condizionatore, che d’estate raffredda una stanza trasferendo calore all’ambiente esterno, decisamente più caldo: ma per farlo consuma un bel po’ di energia elettrica!
William Thompson (Lord Kelvin) diede un’interpretazione apparentemente molto diversa, ma in realtà equivalente, del Secondo Principio, affermando che
“È impossibile costruire una macchina che, operando ciclicamente, trasformi il tutto il calore assorbito da una singola sorgente in lavoro”.
Ad esempio, parte del calore prodotto dalla combustione della benzina in un motore a scoppio, viene inevitabilmente “gettato nel cestino”, dove il “cestino” è purtroppo l’ambiente.
Non è difficile vedere che le due formulazioni sono equivalenti:
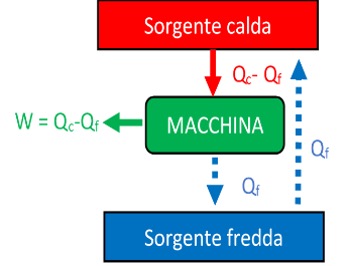
Supponiamo ad esempio di poter violare l’affermazione di Clausius. Allora (vedi figura), potremmo riportare il calore \( Q_f \) ceduto dalla macchina termica dalla sorgente più fredda a quella più calda, con il risultato netto di trasformare interamente il calore \( Q_c-Q_f \) nel lavoro \( W \).
Se invece potessimo prendere del calore dalla sorgente fredda e trasformarlo tutto in lavoro \( W \) (per esempio alzando un peso) senza cederne ad una sorgente ancora più fredda e violando quindi l’affermazione di Kelvin, potremmo usare \( W \) per scaldare la sorgente calda sfruttando ad esempio il peso sollevato per azionare un mulinello di Joule.