3. L’atomo: storia moderna /1
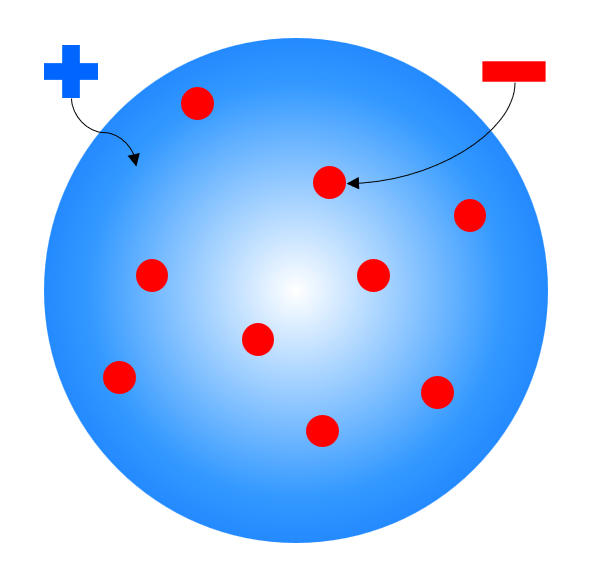
A fine Ottocento, dunque, per interpretare i risultati sperimentali sin lì accumulatisi, Thomson formulò un modello di atomo che prevedeva che l’unità costitutiva della materia fosse a sua volta costituita (perdendo quindi lo status di a-tomo!) da carica elettrica positiva distribuita in un volume sferico, disseminato qua e là di piccole particelle (gli elettroni) recanti carica negativa (vedi figura qui sotto). Un po’ come le uvette in un panettone, oppure i semini in un’anguria.
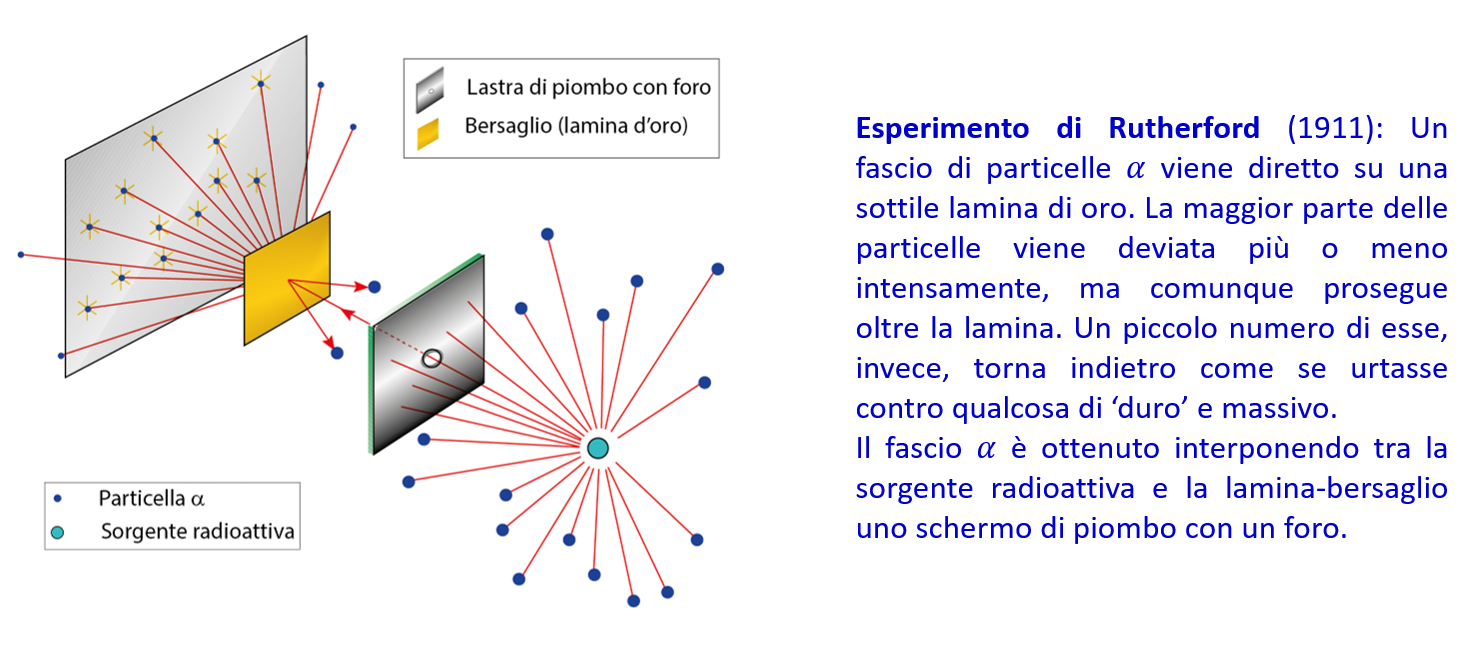
Questo modello fu messo in crisi dai risultati di un celebre esperimento condotto nel 1911 da Ernest Rutherford e collaboratori (illustrato nella figura) i cui esiti suggerivano chiaramente che nei mattoncini costituenti la materia (nello specifico l’oro) fossero presenti dei costituenti molto piccoli, ma con massa molto più grande di quella dell’elettrone, contro i quali le particelle di tanto in tanto urtavano, venendo così respinte dalla parte della direzione di provenienza.