6. Masse molecolari
Avendo a che fare con numeri molto piccoli, si comprende il vantaggio nell’avere definito una “unità di massa atomica” e di esprimere le masse atomiche in funzione di questa unità di misura.
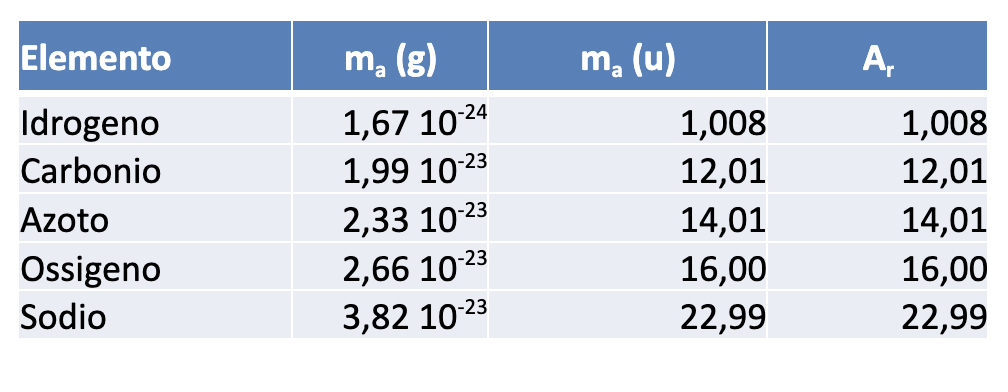
Nella tabella sottostante, sono riportati per alcuni elementi i valori delle masse atomiche espressi in grammi (g) e in unità di massa atomica (u), insieme ai valori delle masse atomiche relative (adimensionate). I dati sono riportati con due cifre significative, fatta eccezione per l’idrogeno.
Una volta note le masse atomiche degli elementi, possiamo calcolare la massa di un composto definito da una data formula chimica. La massa molecolare relativa, \( M_r \), viene calcolata sommando le masse atomiche relative degli elementi presenti, ciascuna moltiplicato per il numero di atomi di quell’elemento presenti nel composto.
Ad esempio:
Sostanza: Acido solforico
Formula: H2SO4
\( Mr = 2 Ar(H) + Ar (S) + 4 Ar (O) = 2 1,008 + 32,07 + 4 16,00 = 98,09 \)
