11. Molecole, ioni, formula minima e formula molecolare
Gli atomi interagendo fra loro possono formare differenti tipi di legami, dando luogo a differenti tipi di composti:
- composti molecolari
- composti solidi ionici
- composti solidi covalenti.
I composti molecolari, possono trovarsi allo stato solido, liquido o gassoso a seconda delle condizioni di temperatura e di pressione. Nei composti molecolari, a livello microscopico, è possibile identificare una unità costitutiva elementare, la molecola.
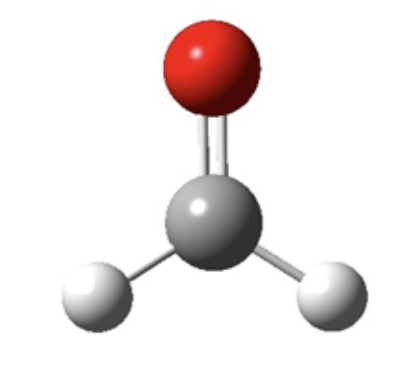
La molecola è un’entità elettricamente neutra (cioè priva di carica positiva o negativa) costituita da due o più atomi o dello stesso elemento (che identifica a livello macroscopico una sostanza semplice) o di elementi diversi (che identifica a livello macroscopico una sostanza composta). In una molecola gli atomi sono fra loro legati attraverso la formazione di legami di tipo covalente, dei quali si parlerà più avanti. Per i composti molecolari è possibile definire la formula molecolare che identifica la composizione della sostanza a livello molecolare. Ad esempio, la formaldeide è una sostanza di formula molecolare CH2O e la molecola della formaldeide ha la seguente formula di struttura:
Non tutte le sostanze però sono formate da molecole. Nei composti ionici e nei composti solidi covalenti gli atomi non formano un'unità discreta (molecola singola), bensì sono legati tra loro secondo uno schema regolare, ordinato e ripetuto in un reticolo cristallino. In queste situazioni la formula minima rappresenta il più piccolo aggregato di ioni elettricamente neutro presenti nel composto ionico o di atomi presenti nel solido covalente.
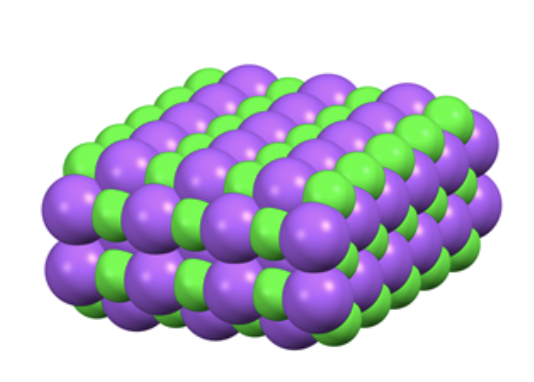
Composti solidi ionici: si presentano allo stato solido (a temperatura ambiente) e sono formati da ioni, cioè da atomi o gruppi di atomi che possiedono una carica elettrica positiva (cationi) o negativa (anioni) e formano un reticolo cristallino ordinato nel quale ioni positivi e negativi si alternano e sono legati da interazioni di tipo elettrostatico. Un esempio di composto solido ionico è il Cloruro di Sodio, ovvero il comune sale da cucina, la cui formula minima è NaCl, e la struttura cristallina del solido è riportata nella figura sottostante, dove in verde sono riportati gli ioni Sodio e in viola gli ioni Cloruro:
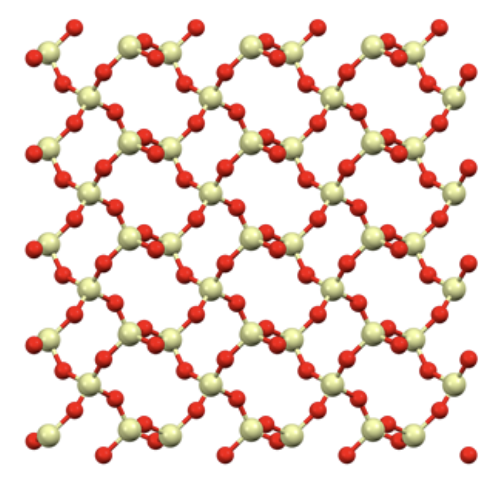
Composti solidi covalenti: sono solidi cristallini composti da atomi che formano legami chimici mediante legami di tipo covalente, ma nei quali non è possibile identificare l’entità “molecola”. Composti solidi covalenti contenenti solo atomi di Carbonio sono il diamante e la grafite; un composto solido covalente a base di Silicio e Ossigeno è il quarzo, la forma cristallina del biossido di silicio, la cui formula minima è SiO2, e la cui struttura cristallina è riportata nella figura sottostante, dove in rosso sono riportati gli atomi di Ossigenoe in giallo gli atomi di Silicio.