2. Il modello atomico di Rutherford
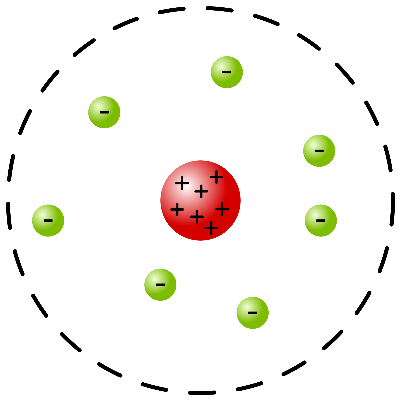
L’atomo di RutherfordNel 1911 il fisico neozelandese Ernest Rutherford eseguì una serie di esperimenti destinati a rivoluzionare i modelli utilizzati fino ad allora per descrivere gli atomi. Utilizzando una sorgente radioattiva, “bombardò” una sottile lamina d’oro con delle particelle alpha, cioè particelle che ora sappiamo essere formate da due protoni e due neutroni. Secondo il modello atomico di Thomson, queste particelle avrebbero dovuto subire una piccola deviazione nella loro traiettoria, a causa della repulsione tra le particelle alfa (cariche positivamente) e la carica positiva distribuita negli atomi dell’oro. Rutherford osservò invece che la maggior parte delle particelle alfa attraversava la lamina d’oro senza subire alcuna deviazione, mentre poche particelle rimbalzavano come se avessero colpito un oggetto impenetrabile.
Sulla base di tali osservazioni Rutherford propose un nuovo modello dell’atomo, secondo cui:
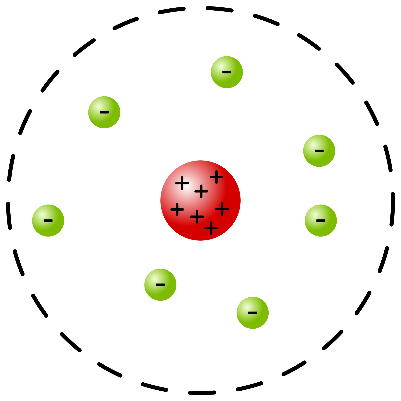
- la carica elettrica positiva dell’atomo è concentrata in un nucleo centrale estremamente piccolo (caratterizzato da un raggio di circa 10-14 m);
- gli elettroni orbitano intorno al nucleo, a una distanza che equivale; all’incirca a diecimila volte il raggio del nucleo. Di conseguenza, secondo questo modello dell’atomo gli elettroni orbitano intorno al nucleo in modo analogo a come i pianeti del sistema solare orbitano intorno al Sole.
Questo nuovo modello di atomo è in accordo con i risultati dell’esperimento di Rutherford in quanto:
- la maggior parte delle particelle alfa è caratterizzata da una traiettoria che passa nello spazio vuoto tra il nucleo e gli elettroni, e quindi attraversa gli atomi senza essere perturbata;
- alcune particelle però colpiscono il nucleo, e quindi rimbalzano.
