4. Funzioni d’onda e numeri quantici /1
Nello stesso periodo in cui Bohr formulava il nuovo modello per descrivere gli atomi, nuove teorie ed osservazioni stavano rivoluzionando la fisica: per spiegare alcune peculiari proprietà della materia, il fisico De Broglie sviluppò una teoria secondo cui la materia poteva essere descritta sia come formata da particelle ma equivalentemente come onde interagenti tra di loro. Quasi contemporaneamente il fisico Heisenberg formulava il cosiddetto principio di indeterminazione, secondo cui non è possibile conoscere contemporaneamente ed esattamente la posizione e la velocità di una particella di massa molto ridotta, come un elettrone.
Queste nuove osservazioni e teorie, che costituiscono le basi su cui si è sviluppata la meccanica quantistica, portarono a dedurre che le informazioni sul moto degli elettroni negli atomi possono essere descritte adeguatamente solo in modo probabilistico. In altri termini, il concetto di orbita di un elettrone si rivela superato e inadeguato.
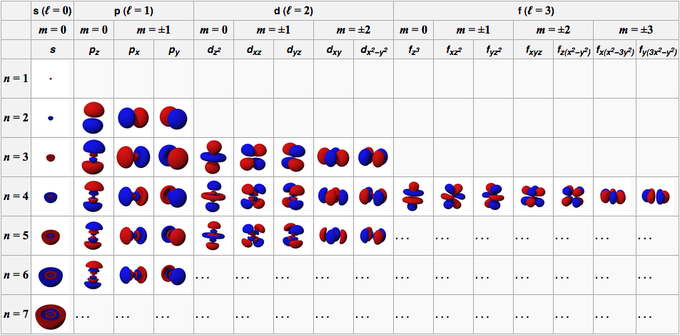
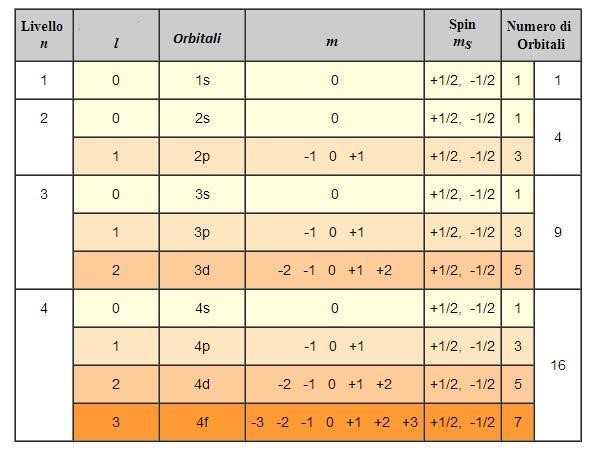
L’oggetto matematico che meglio si adatta per descrivere il comportamento degli elettroni, tenendo conto delle osservazioni di De Broglie e Heisenberg, è l’onda stazionaria. In particolare, le onde stazionarie che descrivono adeguatamente gli elettroni in un atomo si possono ricavare risolvendo una equazione proposta dal fisico Schrödinger nel 1926. Per ottenere soluzioni fisicamente accettabili, nell’equazione di Schrödinger devono comparire dei parametri che possono assumere solo determinati valori (e in questo modo dall’equazione otteniamo delle soluzioni – onde stazionarie – caratterizzate da una energia specifica, quindi quantizzata).
Tale funzione, se elevata al quadrato, fornisce inoltre informazioni sulla probabilità di trovare l’elettrone in un punto particolare dello spazio intorno al nucleo.
