5. Funzioni d’onda e numeri quantici /2
I parametri che devono essere inseriti nell’equazione per risolverla vengono detti numeri quantici (e si indicano con le lettere n, l e m e ms).
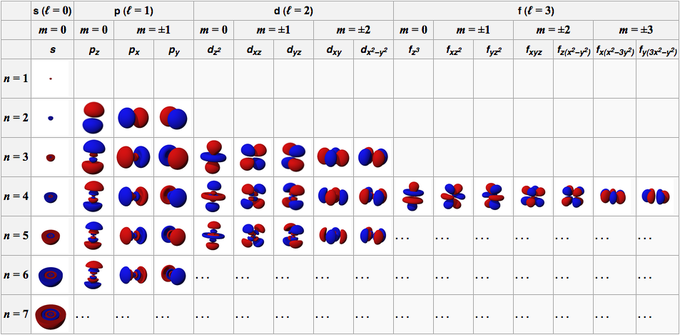
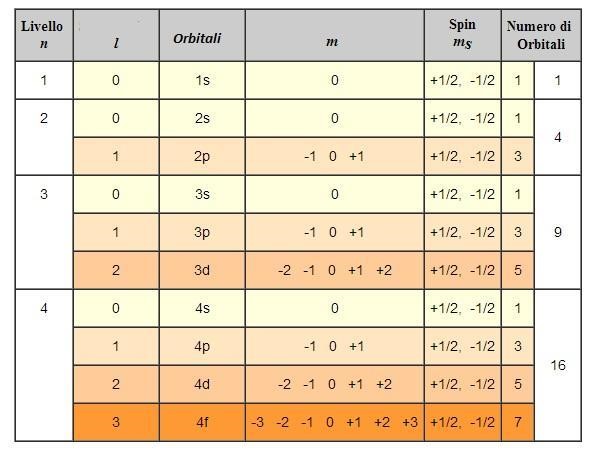
Definiamo l’orbitale come la funzione d’onda dell’elettrone che si ottiene risolvendo l’equazione di Schrödinger utilizzando una particolare quaterna di valori di n, l, m e ms.
- Numero quantico principale n
(n) = 1, 2, 3…,7; cioè numeri interi partendo da 1): definisce il livello energetico dell’elettrone, e definisce la “dimensione” dell’orbitale.
- Numero quantico secondario l
(l = 0, 1,…, n-1; cioè tutti valori interi da 0 a n-1): determina le caratteristiche geometriche (la forma) dell’orbitale.
- Numero quantico magnetico m
(m = -l, 0, +l; cioè tutti i valori interi da -l a +l, zero compreso): definisce l’orientazione degli orbitali.
- Numero quantico di spin ms
(ms = ± 1/2.): indica il valore di spin che può essere associato all’elettrone. Lo spin è una proprietà dell’elettrone che si manifesta quando questo è sottoposto all’azione di un campo magnetico.
Gli elettroni di un atomo non possono essere caratterizzati dai quattro numeri quantici identici, in quanto questo significherebbe avere elettroni con le stesse caratteristiche (e quindi anche elettroni che occupano le stesse regioni intorno al nucleo, con conseguente elevatissima repulsione tra gli stessi). Questo principio viene detto principio di esclusione di Pauli.
