7. Numero atomico e tavola periodica degli elementi
L’identità chimica di un elemento è determinata dal numero dei suoi protoni, ovvero dal numero dei suoi elettroni quando l’atomo è elettricamente neutro. Questo numero viene definito numero atomico e si indica con la lettera Z.
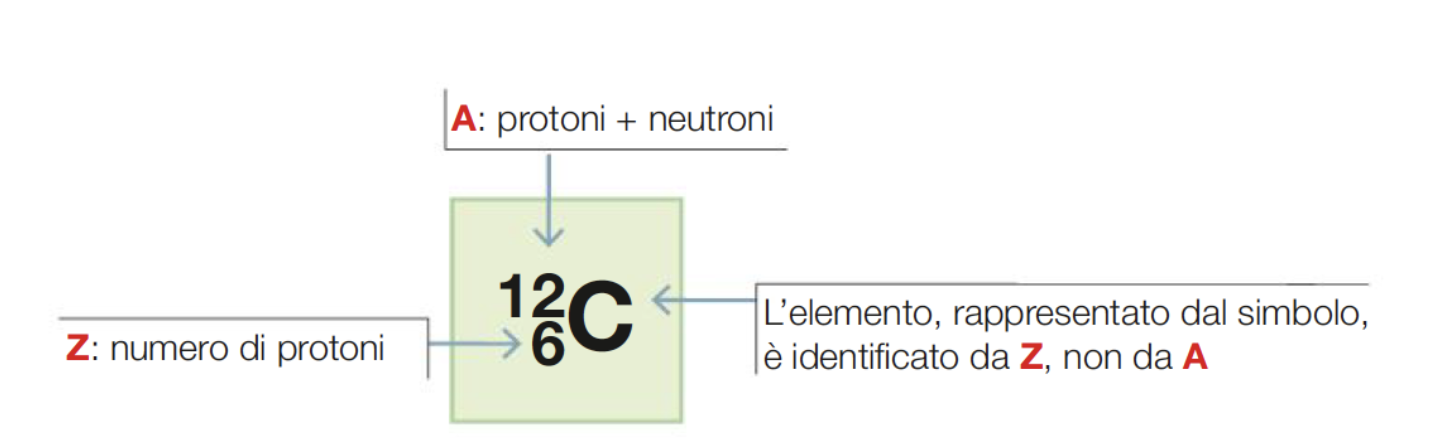
Numero atomico e numero di massa
Il numero di massa (A) viene definito come la somma di neutroni e protoni presenti nel nucleo
Alla luce di queste definizioni, la Tavola Periodica degli elementi è strutturata nel seguente modo:
- Muovendosi da sinistra verso destra, e dall’alto verso il basso, il numero atomico degli elementi aumenta;
- le righe orizzontali vengono dette periodi. Il numero progressivo dei periodi corrisponde al numero quantico principale n;
- le colonne vengono dette gruppi: gli atomi di ciascun gruppo presentano lo stesso numero di elettroni di valenza.
Riassumendo, un elemento è definito in modo univoco dal numero di protoni presenti nel nucleo (che non varia nel corso delle reazioni chimiche, mentre può variare il numero di elettroni); da un nome e da un simbolo; dalla sua posizione nella tavola periodica.
Atomi di uno stesso elemento che presentano un numero differente di neutroni (ovvero presentano differente numero di massa, definito dalla somma del numero di protoni e neutroni presenti nel nucleo) vengono definiti isotopi. Gli isotopi di un elemento presentano proprietà fisiche differenti ma proprietà chimiche identiche.
