9. Proprietà periodiche: Energia di ionizzazione e Affinità elettronica
Una delle proprietà atomiche più rilevanti per razionalizzare il comportamento chimico degli atomi è l’energia di ionizzazione, che viene definita come l’energia che bisogna fornire a un atomo per allontanare uno dei suoi elettroni di valenza (che essendo quelli più esterni, sono quelli che meno risentono dell’attrazione nucleare). L’energia di ionizzazione generalmente aumenta lungo il periodo e diminuisce lungo il gruppo.
Questo andamento è spiegabile considerando che lungo i periodi la carica nucleare efficace aumenta (muovendosi da sinistra a destra), mentre lungo i gruppi la CNE (come definita nelle slide precedenti) rimane costante, ma gli elettroni di valenza sono sempre più lontani dal nucleo via via che si scende lungo il gruppo (dato che il numero di elettroni di core aumenta scendendo nel gruppo).
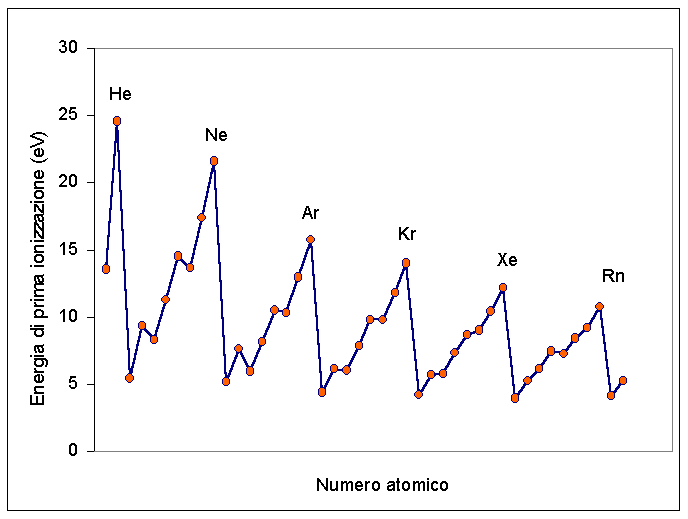
Andamento periodico di Energia di Ionizzazione
Un’altra proprietà atomica rilevante, e in qualche modo complementare all’energia di ionizzazione, è l’affinità elettronica, che viene definita come l’energia che viene liberata per aggiungere un elettrone ad un atomo neutro. L’affinità elettronica diventa generalmente più grande muovendosi lungo un periodo (quindi più energia viene liberata man mano che ci sposta da sinistra a destra lungo il periodo) e più piccola scendendo lungo il gruppo. Analogamente a quanto discusso per l’energia di ionizzazione, anche questo andamento si può semplicemente spiegare tenendo conto di come varia la carica nucleare efficace nella tavola periodica. È importante notare che i gas nobili, che hanno gli orbitali di valenza completamente occupati, sono caratterizzati da una affinità elettronica positiva. Questo perché, nel caso di un gas nobile, il valore di CNE di cui risentirebbe l’elettrone che viene aggiunto all’atomo è zero!
