2. L’andamento dell’elettronegatività nella tavola periodica
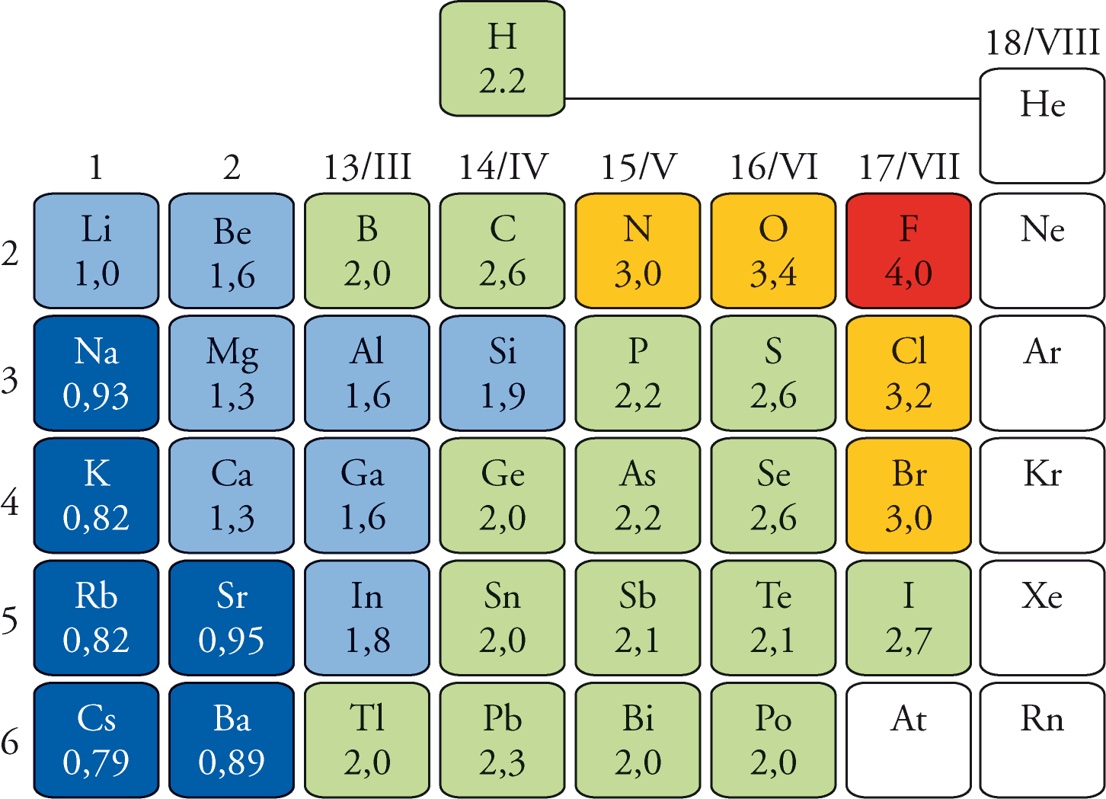
La forza d’attrazione esercitata da un atomo sugli elettroni degli atomi a distanza di legame viene definita elettronegatività.
Essa ovviamente dipende dalla carica del nucleo che non viene schermata dagli elettroni atomici (=Carica Nucleare Efficace). Ma, a differenza delle altre proprietà periodiche (energia di ionizzazione ed affinità elettronica) dipende dalle reciproche interazioni di tutti gli atomi che si combinano, e quindi non è una proprietà intrinseca del singolo atomo. Dunque, essa può essere calcolata tramite diversi modelli teorici, e non deve stupire se diversi scienziati hanno proposto criteri diversi per definire lo stesso concetto. E non deve stupire se i valori nelle diverse scale non sono né uguali, né nello stesso ordine.
La scala di elettronegatività più usata è quella dovuta a Pauling, che ha “inventato” il concetto: ma la definizione più efficace, e che meglio chiarisce il concetto, è stata introdotta da Mulliken nel 1934. Secondo quest’ultimo, l’elettronegatività è proporzionale alla media tra affinità elettronica e energia di ionizzazione [EN ∝ (EI - AE)/2]. Infatti queste due grandezze misurano, da una parte, la tendenza di un atomo a catturare elettroni, e, dall’altra, la sua resistenza a perderne. È quindi del tutto ovvio che l’elettronegatività segue fedelmente l’andamento di queste due proprietà periodiche (molto elevata nell’angolo in alto a destra della tavola periodica, molto bassa nell’angolo in basso a sinistra). In particolare, i “top five” nella classifica dell’elettronegatività sono F, O, N, Cl, Br e gli “ultimi in classifica” gli elementi più pesanti dei gruppi 1° e 2° (Sr, Ba, Rb, Cs).
Quindi l’elettronegatività è un parametro numerico molto efficace per prevedere il comportamento chimico degli elementi. Elementi con elettronegatività alta (colori rosso e giallo in figura) tenderanno, nei loro composti, ad accumulare elettroni. All’opposto, elementi con elettronegatività bassa (colore blu e azzurro nella figura), non saranno in grado di trattenere i propri elettroni (nessun atomo tende a perdere i propri elettroni), quindi saranno caricati positivamente.
In generale se i due atomi che interagiscono hanno elettronegatività molto diversa, uno esercita una forza d’attrazione molto superiore all’altro, e si ha uno spostamento notevole della nuvola elettronica. In questo caso, si parla di legame ionico.
Invece, quando i due atomi che interagiscono sono molto simili (o addirittura identici) la nuvola elettronica rimane confinata tra i due nuclei. In questo caso, si parla di legame covalente.
