3. Il legame ionico porta a reticoli estesi, il legame covalente genera molecole
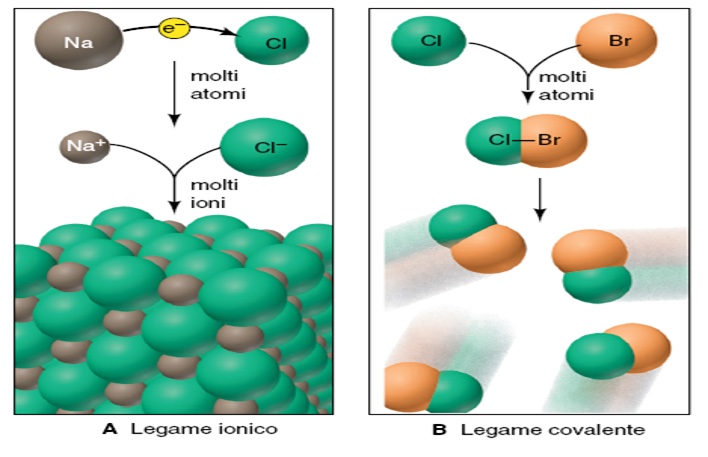
LEGAME IONICO
Se un solo atomo poco elettronegativo (uno dei primi gruppi della tavola periodica) reagisce con un solo atomo di un elemento molto elettronegativo (una situazione molto poco realistica) si ha una notevole ridistribuzione di carica tra gli atomi coinvolti, e si forma un aggregato biatomico con due estremità a cariche opposte (una coppia ionica). Le due estremità sono dette ioni (ione negativo= anione, ione positivo= catione).
Ma se il numero di atomi reagenti aumenta, (una situazione molto più verosimile) avviene un fenomeno molto diverso, e ogni atomo si circonda di molti altri ioni, formando aggregati molto più grossi. Si formano cioè reticoli ordinati tridimensionali detti cristalli ionici. La disposizione degli ioni in questi cristalli non è per nulla casuale, e deve massimizzare le attrazioni tra ioni di carica opposta (e quindi massimizzare le interazioni anione-catione) ma deve minimizzare le repulsioni tra ioni di carica uguale e quindi massimizzare la distanza tra gli anioni (e tra i cationi). In pratica ogni catione sarà circondato da molti anioni (e viceversa), evitando che questi stiano troppo vicini tra loro.
