8. Istruzioni per le formule di Lewis
LE ISTRUZIONI PER DISEGNARE UNA FORMULA DI LEWIS
- Stabilire il numero di elettroni di valenza (sommare gli elettroni di valenza di tutti gli atomi coinvolti ± l’eventuale carica)
- Mettere l’atomo meno elettronegativo al centro
- Mettere gli atomi più elettronegativi intorno
- Disegnare legami covalenti tra gli atomi
- Assegnare ad ogni atomo periferico tante coppie di elettroni quante ne servono per raggiungere l’ottetto
- Gli elettroni che avanzano vengono aggiunti all’atomo centrale
- SE l’atomo centrale non raggiunge l’ottetto, togliere una coppia di elettroni da un atomo periferico e usarla per un legame aggiuntivo.
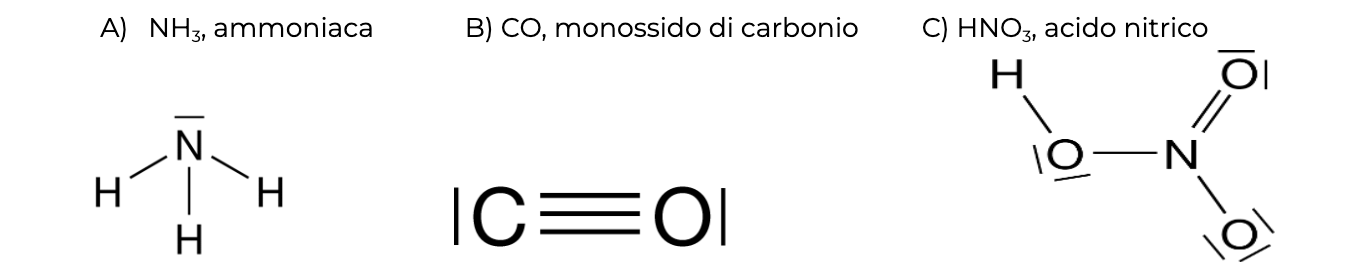
Dagli esempi su riportati si può vedere che le coppie di elettroni (le sbarrette) possono avere vari ruoli. Possono essere localizzate su un unico atomo (coppie di non legame), possono essere condivise tra due atomi (legame singolo) o possono esserci più coppie condivise tra gli stessi due atomi (legame multiplo, doppio o triplo). Al giorno d’oggi sappiamo che ciascuna coppia occupa un orbitale.
È chiaro che questi schemi semplificati non possono rappresentare rigorosamente la situazione effettiva, ma possono permettere di intuire la disposizione tridimensionale degli atomi (la geometria molecolare), l’accumulo di carica sugli atomi (la polarità molecolare), la forza dei legami. In molti casi, servono anche a spiegare come avvengono le reazioni chimiche.
