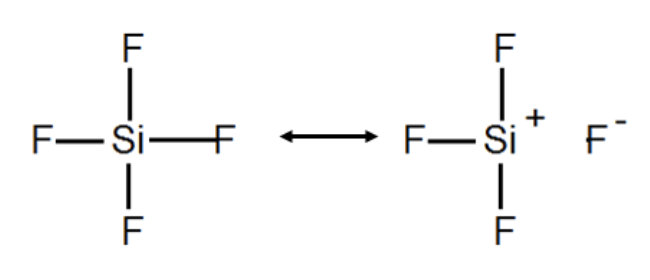Completion requirements
View
9. Le formule di risonanza
Può capitare che ci siano più formule di Lewis che rispettano tutte le regole enunciate. In questi casi si parla di formule di risonanza. Esse vanno interpretate come formule estremamente semplificate della situazione reale, e tutte insieme contribuiscono a descrivere la complessità molecolare. In alcuni casi, le diverse formule sono simili, ma con orientazioni diverse. Per esempio, l’ozono (O3) può essere rappresentato con due formule di risonanza “degeneri” (di uguale energia, e quindi di uguale importanza).
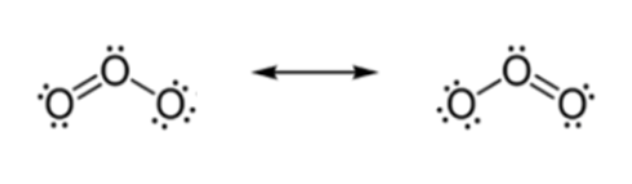
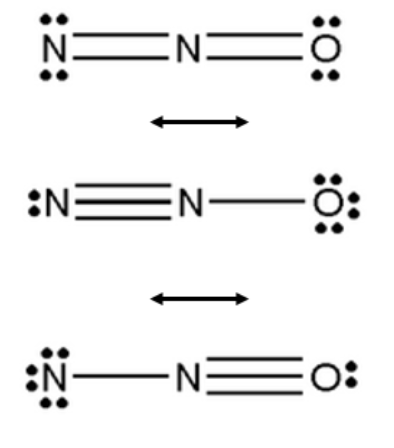
L’ambiguità delle formule di risonanza è proprio il limite principale delle formule di Lewis. Ma, in un certo senso, può anche essere considerato un pregio, perché l’insieme di questi schemi semplificati permette di interpretare fenomeni che altrimenti richiederebbero difficili strumenti matematici.
Bisogna ribadire che gli elettroni non sono puntini (disegnati sul foglio) che vanno collocati in un punto preciso. Al contrario, sono funzioni d’onda che possono essere “spalmate” su zone estese della molecola (il termine corretto è delocalizzazione).
Legame ionico e legame covalente sono due situazioni estreme (legame ionico = separazione di carica, legame covalente = condivisione di elettroni). Si possono avere anche tutte le situazioni intermedie, per cui è opportuno parlare di legami polari, in cui le due componenti contribuiscono entrambe alla formazione del legame (c’è sia un alto grado di condivisione, sia una rilevante separazione di carica). In questo caso si può parlare di percentuale di ionicità, e descrivere il legame con due formule di risonanza (ionica e covalente) di peso diverso.