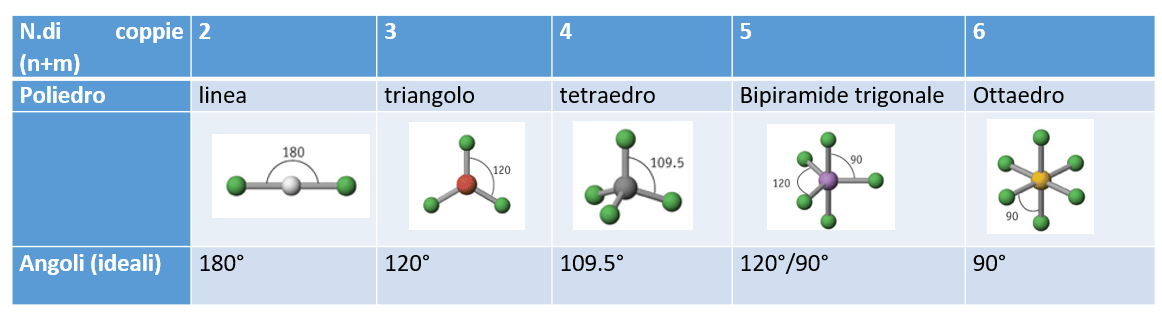
11. Le geometrie ideali e le geometrie effettive secondo la VSEPR
Le formule di Lewis ci permettono di prevedere anche la geometria molecolare, (cioè la disposizione tridimensionale degli atomi), prevedendo con buona approssimazione gli angoli di legame.La popolare teoria che permette di ricavare la geometria molecolare è nota con il suo acronimo inglese, VSEPR (Valence Shell Electron Pair Repulsion). Il successo dalla VSEPR deriva dal fatto che le sue previsioni sugli angoli di legame sono in ottimo accordo con i dati sperimentali (che possono essere misurati o tramite diffrazione ai raggi X nei solidi o grazie alla spettroscopia in fase gassosa).
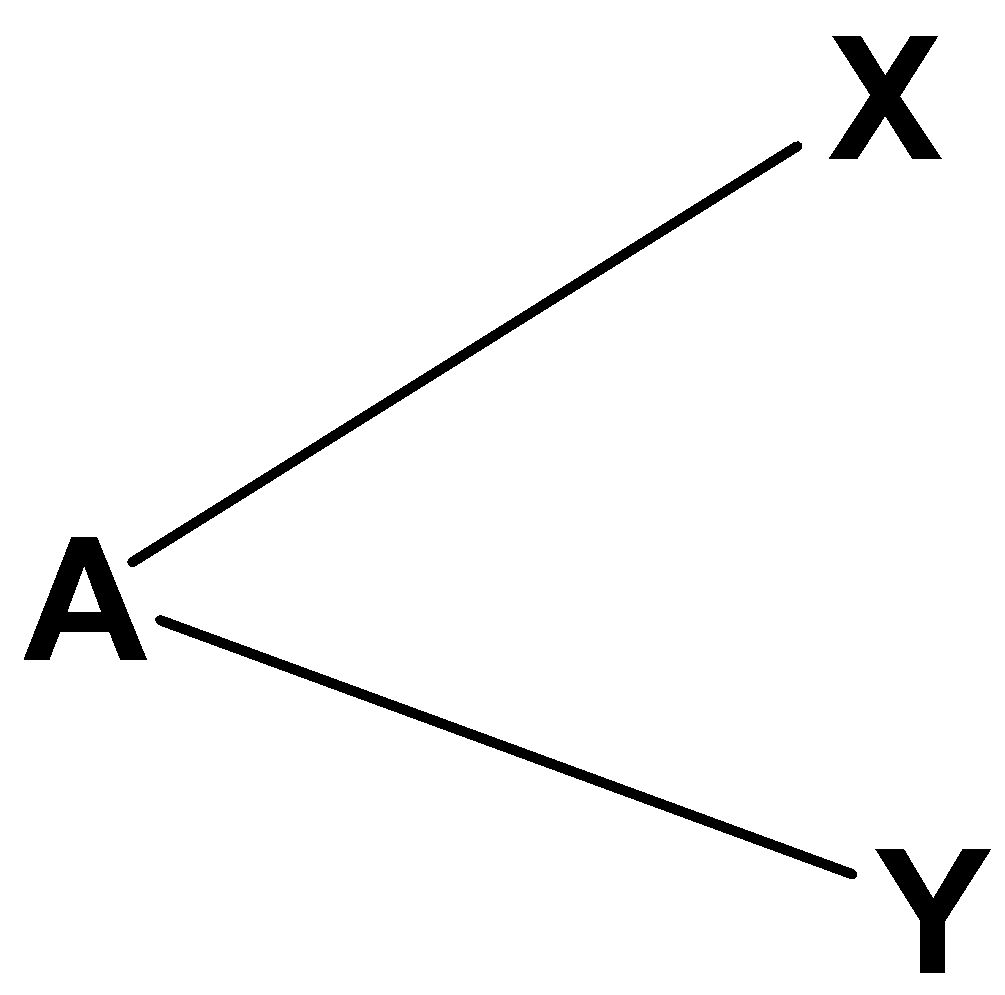
La teoria si basa sulla repulsione delle coppie elettroniche: gli elettroni sono carichi, e si respingono. Per stabilizzare la molecola gli elettroni adotteranno gli angoli più grandi possibili. Massimizzare gli angoli significa massimizzare le distanze (tra elettroni) e minimizzare le repulsioni.
I solidi tridimensionali che massimizzano gli angoli al centro sono raffigurati in tabella: