13. La polarità molecolare
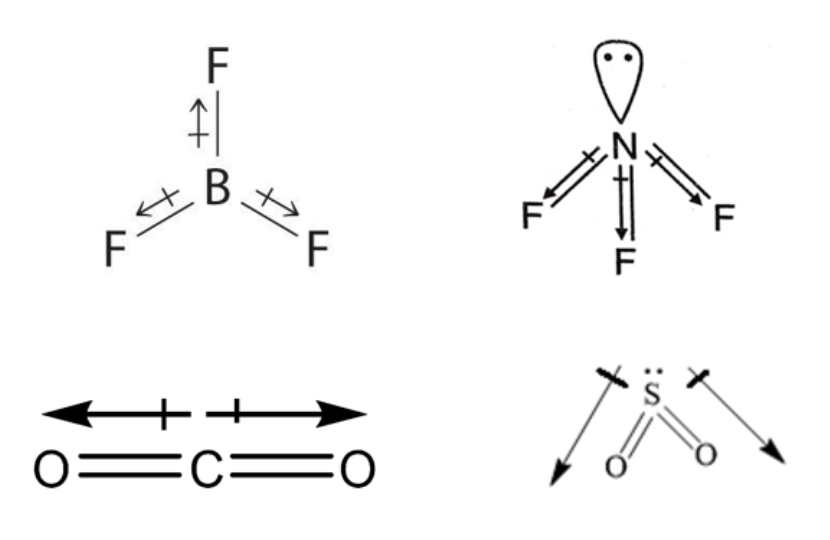
Quindi se due atomi con elettronegatività diversa formano un legame si genera un dipolo elettrico. In una molecola con molti legami i dipoli si sommano (vettorialmente) e il risultato netto dipende dalla simmetria molecolare. In molecole molto simmetriche, con atomi tutti uguali e senza coppie di non legame (AXn), la somma dei vettori ha risultante nulla in ogni direzione, e quindi il momento di dipolo elettrico molecolare è nullo. Invece molecole di bassa simmetria hanno un momento di dipolo elettrico non nullo. Si considerino ad esempio le due molecole BF3 e NF3. La differenza di elettronegatività è maggiore in BF3 che in NF3. Ma la prima ha una geometria triangolare planare e i vettori associati ai tre legami si annullano. Invece in NF3 (piramide triangolare) la componente vettoriale lungo l’asse molecolare si somma e ne risulta un momento di dipolo misurabile. Allo stesso modo, CO2 e SO2 hanno geometria diversa. La prima è lineare e apolare, la seconda è angolata e polare.
Un dipolo elettrico viene orientato da un campo elettrico esterno e quindi molecole polari e apolari hanno un comportamento diverso in presenza di un campo elettrico: le molecole polari interagiscono con un campo elettrico, e ne vengono orientate. Si parla di comportamento dielettrico.
