14. Le diverse tipologie di forze intermolecolari
FORZE INTERMOLECOLARI
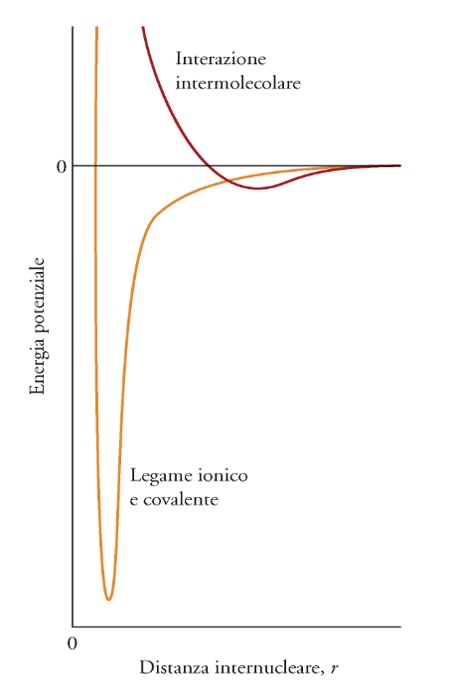
Anche le molecole possono esercitare forze elettrostatiche verso gli elettroni di altre molecole, dette generalmente forze intermolecolari o forze di van der Waals. Poiché queste forze si esercitano tra molecole (con l’ottetto completo) il principio di Pauli impedisce loro di avvicinarsi, e quindi l’energia coinvolta in questi fenomeni è minore di quella coinvolta nei legami ionici o covalenti (spesso anche molto piccola) ma si tratta comunque di fenomeni importanti, soprattutto perché la presenza di queste forze ha profonde conseguenze sul comportamento delle diverse sostanze, e ne spiega molte caratteristiche macroscopiche che ci sono familiari.
Poiché sono convolte specie di natura (e carica) diversa, anche i modelli fisici necessari per descrivere queste forze sono diversi. Ne risultano forze molto diverse per intensità che possono dipendere delle cariche presenti (q), dal momento di dipolo (p) o dalla polarizzabilità (α per le molecole apolari). Questo ultimo termine può essere definito come la capacità della materia di generare un dipolo in presenza di un campo elettrico. È chiaramente dipendente dalla mobilità degli elettroni, e quindi dal numero di elettroni posseduti, e dal volume atomico.
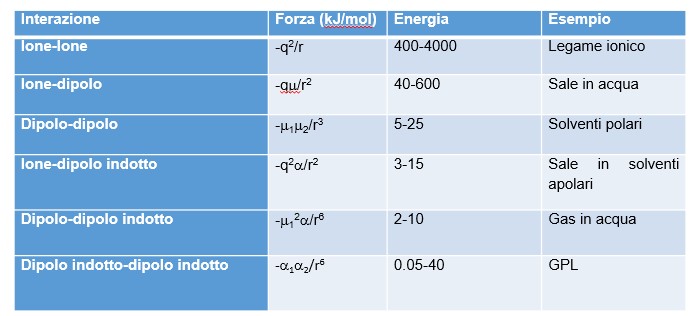
L’energia di queste interazioni dipende in modo diverso dalla distanza (r). Sulla base di tutte queste premesse possiamo catalogare le varie forze in un’unica tabella.
N.B.: la prima riga della tabella corrisponde alla formazione di legami ionici. Non dovrebbe essere inclusa tra le forze intermolecolari, ma è utile come termine di confronto.
- Le interazioni ione-dipolo sono quelle che si instaurano, ad esempio, quando un sale si scioglie in acqua. L’acqua può interagire efficacemente con i cationi (positivi) tramite l’atomo di ossigeno, e con gli anioni tramite gli atomi di idrogeno. L’energia coinvolta in questo processo si chiama energia di idratazione. La formazione di legami ione-dipolo avviene anche con le teste (ioniche) dei tensioattivi e rende possibile la formazione di micelle, che permettono la sospensione dei grassi (apolari) in acqua.
- Molecole polari possono interagire tra loro con una opportuna orientazione dei dipoli. Sono interazioni tipiche dei solventi organici quali acetone, etere, trielina.
- Quando una molecola apolare si trova in un campo elettrico esterno, essa può deformare la sua nuvola elettronica in modo da opporsi al campo. In questo caso si dice che si è polarizzata. L’entità di queste deformazioni è piccola, e non è costante nel tempo. Quindi, le energie coinvolte sono notevolmente minori che nei casi precedenti
- Anche le molecole apolari possono interagire tra loro tramite la polarizzazione. Le fluttuazioni (casuali) di carica su una molecola causano una polarizzazione delle molecole vicine. L’entità di queste deformazioni è maggiore, se la nuvola elettronica è estesa e poco vincolata dai nuclei atomici, cioè negli atomi con molti elettroni negli orbitali con elevati numeri quantici (n = 4, 5). Quindi le energie associate, in presenza di questi elementi, saranno maggiori. Questo effetto è evidentissimo nei punti di fusione delle molecole biatomiche degli alogeni: F2 e Cl2 sono gassosi a temperatura ambiente, Br2 è liquido, I2 è un solido. Infine, molecole di forma “allungata” avranno una superficie maggiore, in cui possono generarsi queste fluttuazioni, e interagire più efficacemente.
