15. Il legame idrogeno
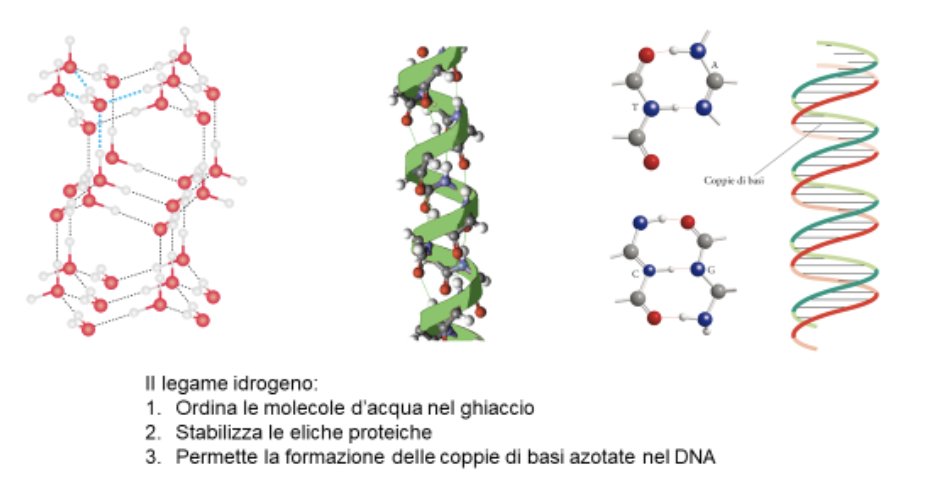
Una forma particolare di interazione dipolo-dipolo si ha quando un atomo di idrogeno è legato covalentemente ad un atomo molto elettronegativo. Poiché l’atomo di idrogeno non ha elettroni interni, la formazione del dipolo genera una carica positiva molto concentrata, che esercita una forza coulombiana molto elevata. I legami idrogeno si formano quando un atomo di idrogeno (legato ad F,O, N) interagisce con un dipolo di un’altra molecola.
Le energie coinvolte, in questa situazione, sono notevoli (10-40 kJ/mol) intermedie tra quelle tipiche delle interazioni dipolo-dipolo e quelle dei legami covalenti.
La molecola più famosa che genera legami idrogeno è l’acqua. Le proprietà dell’acqua che dipendono direttamente da questi legami sono la sua alta temperatura di ebollizione, la sua elevata capacità termica, la variazione di densità al punto di fusione.
Ma anche le molecole biologiche sfruttano i legami idrogeno. Tali legami sono sufficientemente deboli per poter essere rotti con dispendio modesto di energia, ma sufficientemente forti per poter guidare nella costruzione delle macromolecole biologiche. Le catene proteiche sono stabilizzate dalla formazione di legami idrogeno tra i gruppi ammidici e i gruppi carbonilici (N-H-----O=C). Le basi azotate nel DNA possono formare legami idrogeno solo nella giusta combinazione, e questo permette la replicazione del DNA senza errori (che causerebbero le mutazioni).
