4. Proprietà fisiche dei composti binari covalenti
La combinazione di due elementi posti a destra nella tavola periodica (Gruppi 14-17) restituisce composti binari molecolari.

A differenza di quelli ionici, i composti binari molecolari presentano un’ampia varietà di strutture e proprietà fisiche.
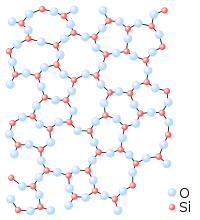
Molti ossidi sono gassosi (come CO, CO2, NO, NO2) o sono solidi bassofondenti (come N2O5, SO3). In altri casi, tuttavia, possono dar vita a specie refrattarie come la silice, SiO2, che fonde a 1710°C.
Il motivo è legato alla diversa natura dei legami intermolecolari: per esempio, mentre allo stato solido le molecole apolari di diossido di carbonio interagiscono molto debolmente (e il solido, detto ghiaccio secco, sublima già a temperatura ambiente), il diossido di silicio è un solido reticolare con una rete estesa di legami Si–O.