5. Proprietà fisiche dei composti binari covalenti: l’acqua
Appartengono a questa categoria di composti anche quelli contenenti idrogeno, come gli alogenuri HF, HCl, HBr e soprattutto l’acqua, H2O, le cui proprietà uniche e spettacolari sono un riflesso dell’elevata differenza di elettronegatività tra ossigeno e idrogeno e della geometria angolata.
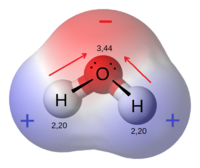
L’elevata polarità che ne deriva consente di instaurare interazioni dipolo-dipolo note con il nome di legame a idrogeno, in cui l’atomo di idrogeno è a ponte tra l’atomo di ossigeno a cui è legato covalentemente e un atomo di ossigeno di una molecola adiacente.
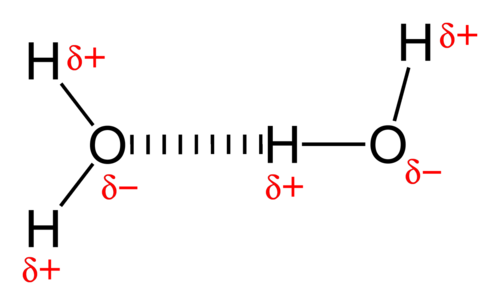
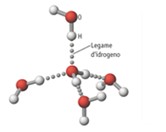
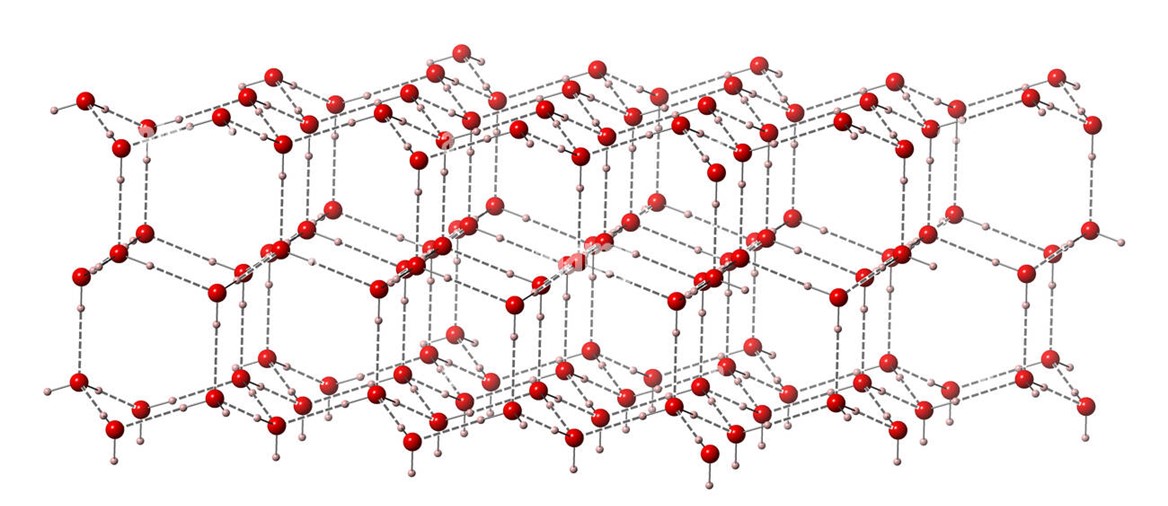
Allo stato solido, i legami a idrogeno impegnano gli atomi di idrogeno e di ossigeno di tutte le molecole d’acqua presenti nel cristallo, al punto che ciascuna di esse è impegnata in quattro legami a idrogeno.
Per realizzare questa fitta trama, le molecole devono distanziarsi le une dalle altre, e la struttura si espande: questo restituisce al ghiaccio la proprietà singolare di essere meno denso dell’acqua liquida, e quindi di galleggiarvi.
Altre peculiari proprietà dell’acqua sono il punto di ebollizione e il calore di evaporazione insolitamente alti, e la capacità del ghiaccio di fondere se sottoposto a pressione.
