6. L’espressione della concentrazione: la molarità, la molalità e la frazione molare
La molarità è definita come il numero di moli di soluto presenti in un litro di soluzione. Si indica con il simbolo M, e la sua unità di misura è mol/L:
\( C(M)= \frac{n_{soluto} (mol)}{V_{soluzione} (L)} \)
Per esempio, una soluzione acquosa di solfato di rame (CuSO4) 0,40 M contiene 0,40 moli di solfato di rame (pari a 64 g) in ogni litro di soluzione .

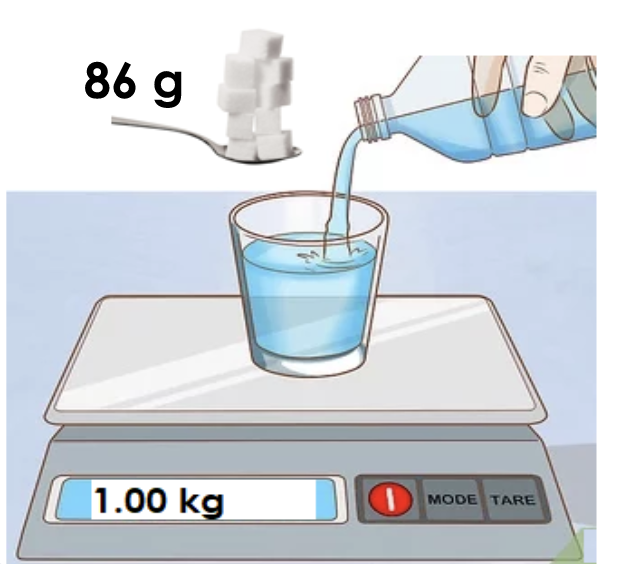
La molalità è definita come il numero di moli di soluto presenti in un chilogrammo di soluzione. Si indica con il simbolo m, e la sua unità di misura è mol/kg:
\( C(m)= \frac{n_{soluto} (mol)}{V_{solvente} (kg)} \)
Per esempio, una soluzione acquosa di saccarosio (C12H22O11) 0,25 m contiene 0,25 moli di zucchero (pari a 86 g) in ogni chilogrammo di acqua.
La frazione molare di un componente \( i \) di una soluzione è definita come il numero di moli del componente \( i \) diviso la somma delle moli di tutti i componenti. Si indica con il simbolo \( x \), ed è adimensionale:
\( x_i= \frac{n_{i} (mol)}{n_{totali} (mol)} \)
È un numero compreso tra 0 e 1, dove 0 e 1 rappresentano due casi limite: è 0, quando il componente \( i \) è assente; è 1, quando c’è solo il componente \( i \), e quindi si tratta di una sostanza pura.
