7. Il processo di dissoluzione
È esperienza comune che, aggiungendo un po’ di sale a un bicchiere d’acqua, ne vediamo i cristalli sparire al suo interno, fino a ottenere una soluzione liquida omogenea.

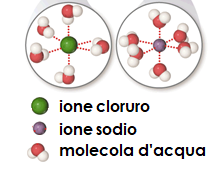
Cosa è successo? Quando aggiungiamo i primi granelli di sale, le molecole d’acqua si avvicinano ai cristalli e ne smantellano il reticolo ionico: gli ioni Na+ e Cl– passano in soluzione circondati da molecole d’acqua che si orientano con la polarità di segno opposto, instaurando con gli ioni una interazione forte ione-dipolo permanente: gli ioni cloruro, negativi, sono circondati da molecole di acqua che si avvicinano tramite gli atomi di idrogeno (sede di una parziale carica positiva), mentre gli ioni sodio, positivi, sono circondati da molecole di acqua che si avvicinano attraverso gli atomi di ossigeno (sede di una parziale carica negativa). Gli ioni si trovano, così idratati, all’interno della soluzione.
Se però insistiamo nell’aggiunta, a un certo punto i cristalli di sale non si scioglieranno più, e li vedremo depositarsi sul fondo del bicchiere. Continuando ad aggiungere, il deposito sul fondo aumenta sempre di più. Apparentemente, il sistema bifasico, costituito dalla soluzione e dai granelli indisciolti, resta in quiete.

