11. La solubilità dipende dalla pressione
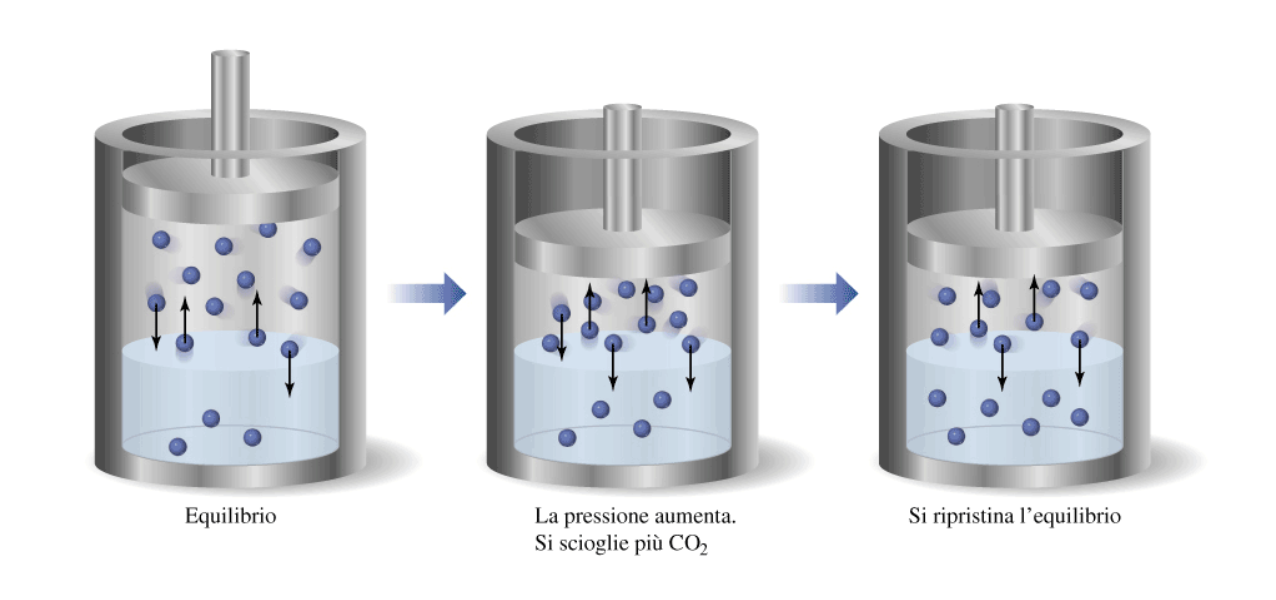
La solubilità dipende apprezzabilmente dalla pressione solo nel caso in cui il soluto sia un gas. In questo caso, la solubilità aumenta sempre all’aumentare della pressione, secondo la legge di Henry:
\( C\left(\begin{array}{c}\frac{mol}{kg}\\ \end{array}\right)=k_H\left(\begin{array}{c}\frac{mol}{kg\cdot atm}\\ \end{array}\right)\cdot P(atm) \)
C è la concentrazione, P è la pressione e kH è una costante che dipende dalla natura del solvente e del soluto.
Questa dipendenza è una conseguenza del principio di Le Chatelier, perché un aumento di pressione su un sistema contenente un gas in equilibrio con una sua soluzione acquosa può essere minimizzato riducendo il numero di particelle in fase gassosa. Questo si traduce nel passaggio netto di molecole dalla fase gassosa a quella liquida, con conseguente aumento della concentrazione di quest’ultima.