3. La reazione dell’acqua con sé stessa /2
La costante di equilibrio della reazione di autoprotolisi dell’acqua Kc è:
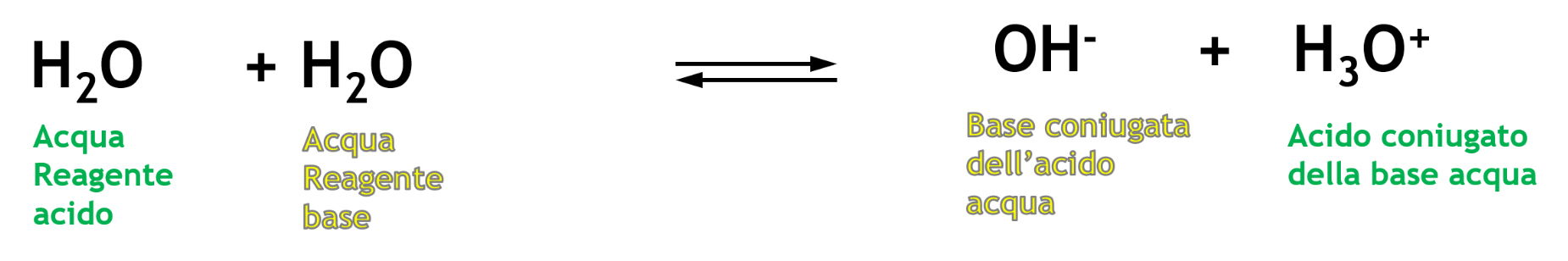
\( K_c=\frac{[OH^{-}][H_{3}O^{
+}]}{[H_2O]^{2}} \)
e si vede come, con un semplice riarrangiamento matematico,
da essa si possa ottenere una nuova costante talmente importante che le è stato dato uno specifico nome: Kw dove il pedice w indica la parola water, cioè acqua in inglese.
\( K_W=K_c[H_2O]^2= [OH^-][H_3O^+]=1.00\times10^{-14}M^2 \)
Dal momento che il valore della costante è molto piccolo, la quantità di acqua che reagisce è pochissima e si può considerare la concentrazione dell’acqua costante. Per questo è possibile inglobarla in una nuova costante che viene chiamata costante di autoprotolisi dell’acqua Kw.
Come tutte le costanti di equilibrio, anche Kc dell’autoprotolisi dell’acqua dipende dalla temperatura a cui la reazione viene fatta avvenire: a 25°C (temperatura standard, cioè di riferimento, per le soluzioni) il suo valore è tale per cui Kw risulta appunto 10-14 M2\( K_W=[OH^-][H_3O^+]=1.00×10^{-14}M^2 \)
Qualitativamente possiamo già capire come l’acqua sia poco attiva sia come acido che come base, possiamo dunque chiamarla debole in entrambe le sue attività, perché produce pochissimi ioni OH- e H3O+ per reazione di autoprotolisi.
A questo punto, sapendo il valore di Kw, possiamo calcolare quanti OH- e H3O+ produce esattamente per ogni litro di acqua!
